
| A、△H>0,△S>0的反应任何条件都是非自发反应 |
| B、因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
| C、一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当v正(SO2)=v正(SO3)时,说明该反应已达到平衡状态 |
| D、H2标准燃烧热△H=-285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ?mol-1 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、将煤块粉碎后燃烧 |
| B、将食物贮藏在冰箱中 |
| C、用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| D、用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol OH-含有的电子数目为9NA | ||
| B、1mol Cl2和氢氧化钠完全反应,转移的电子数目为NA | ||
| C、室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | ||
D、1mol
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0、△S<0 |
| B、△H>0、△S<0 |
| C、△H<0、△S>0 |
| D、△H>0、△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
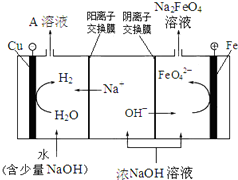 高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂.
高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂.查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
C、14+
| ||||
D、14+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应在常温下都能自发进行 |
| B、Fe3++3H2O?Fe(OH)3+3H+是吸热反应 |
| C、熵值大小关系为:S(冰)>S(水)>S(水蒸气) |
| D、对C(s)+H2O(g)?CO(g)+H2(g),多加些炭可以提高化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
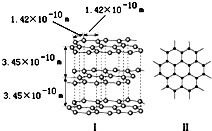 (1)石墨是层状结构,如如图所示.每一层内的碳原子间通过sp2杂化形成
(1)石墨是层状结构,如如图所示.每一层内的碳原子间通过sp2杂化形成查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com