
【题目】如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,v(A)=v(B)=a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X+Y![]() 2Z+W;(X、Y、Z、W均为气体)正反应为放热反应,达到平衡时,v(A)=1.2a L。
2Z+W;(X、Y、Z、W均为气体)正反应为放热反应,达到平衡时,v(A)=1.2a L。
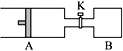
试回答:
(1)A中X的转化率α(A)_______________________________________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
【答案】40% >2.6a
【解析】
(1)A为恒温恒压过程,体积之比等于物质的量之比,据此计算平衡后A中混合气体的物质的量,根据差量法计算参加反应的X的物质的量,根据转化率定义计算;
(2)A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积增大的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B容器与A相比相当于增大了压强;
(3)开K保持温度不变,A、B为等效平衡;
(1)A为恒温恒压过程,达到平衡时V(A)=1.2a L,等压等温条件下,气体的体积之比等于气体的物质的量之比,所以平衡后混合气体的物质的量是2mol×1.2=2.4mol,设参加反应的X的物质的量为x mol,
X + Y![]() 2Z + W
2Z + W ![]()
1 1 2 1 1
X 2.4-2;
![]()
X=0.4mol,所以A中X的转化率α(A)![]() ;
;
(2)A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积增大的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B容器与A相比相当于增大了压强,平衡逆向进行,平衡后A中的X的转化率大,所以α(A) >α(B);
(3)打开K,保持温度不变,A、B为等效平衡,B投料为A的2倍,所以A中平衡后气体的体积为2.4a,则总体积为3.6a,A的体积为3.6a-a=2.6aL;


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】物质的性质决定其用途。下列物质的用途中,利用其物理性质的是( )
A.镁粉用于制作照明弹B.稀有气体用于制作霓虹灯
C.氧气用于医疗急救D.氮气用作充氮包装,保存食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语描述中不正确的是( )
A. 中子数为20的氯原子:![]()
B. K2O的电子式:![]()
C. HCO3﹣的电离方程式:HCO3﹣+H2O![]() CO32﹣+H3O+
CO32﹣+H3O+
D. 比例模型![]() 可以表示CO2分子或SiO2
可以表示CO2分子或SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)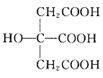 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
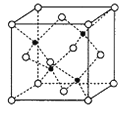
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在镀锌铁皮的锌镀层厚度的测定过程中,下列操作会导致测定结果偏高的是
A.过早判断反应终点B.在测定铁皮的面积时测得面积比铁皮的实际面积大
C.过迟判断反应终点D.锌在酸中溶解后,铁皮未烘干就去称重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对温室气体CO2进行减排和综合治理具有重要意义。回答下列问题:
Ⅰ. O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。

(1)电池的负极反应式:______________________________________________ 。电池的正极反应式:6O2+6e![]() 6O2 ;6CO2+6O2
6O2 ;6CO2+6O2![]() 3C2O42 + 6O2
3C2O42 + 6O2
(2)反应过程中O2的作用是________。
(3)该电池的总反应式:_________________________________。
Ⅱ. CH4-CO2催化重整不仅对温室气体的减排具有重要意义,还可以得到合成气(CO和H2)。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1 =+206.2 kJ/mol K1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH2 = +165.0 kJ/mol K2
(4)写出该催化重整反应的热化学方程式__________________________________________。
K=_________(用 K1 、K2表示)
(5)恒温恒压下,向容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,此时体积为2 L,一段时间后达到平衡时,CO2的转化率是50%,其平衡常数为_______。
(6)分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体让其发生催化重整反应。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
(7)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
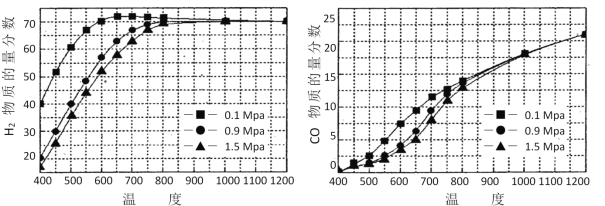
若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是___。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com