
(共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
|
IA |
|
|
|
|
|
|
0 |
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
|
⑦ |
|
⑧ |
|
(1)、④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号)。
②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)、①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)、由表中两种元素的原子按 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2 b.Na2SO4 c.Na2SO3 d.CaCO3
(4)、由表中元素形成的物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为 ;
常温下,为使0.1 mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至pH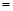 。
。
(1). Na>Al>O (1分) HClO4>H3PO4> H2CO3 (1分)
(2).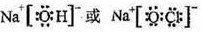 (1分)
(3). a (1分)
(1分)
(3). a (1分)
(4).Al3++3NH3•H2O→Al(OH)3↓+3NH4+ (2分) pH=7 (2分)
【解析】根据元素在周期表中的位置可知,①-⑧分别是H、C、N、O、Na、Al、P、Cl。
(1).同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。非金属性越强,最高价氧化物的水化物的酸性越强,所以答案是Na>Al>O 、 HClO4>H3PO4> H2CO3。
(2)符合条件的是氢氧化钠或次氯酸钠,电子式分别是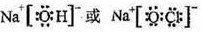
(3)该液态化合物是双氧水,常用二氧化锰作催化剂,答案选a。
(4)M是只含有非金属元素的盐,因此是铵盐。X和Y的反应应该是复分解反应,所以Z是沉淀,即为氢氧化铝,氢氧化铝加热分解得到氧化铝,氧化铝电解得到单质铝。所以X、Y分别是铝盐和氨水。M中NH4+水解显酸性,所以应该加入氨水,才有可能使M溶液中电离出的阴、阳离子浓度相等。根据电荷守恒可知,当pH=7时即可。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【化学-选修物质结构与性质】(共12分)
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
|
| |||||||||||||||
| B | C |
| D | E | F | G | H | I | |||||||||
| J | K |
|
|
| M | N |
| ||||||||||
|
|
|
|
|
|
|
| Fe |
|
|
|
|
|
|
|
|
|
|
试依据信息回答下列问题:
(1)上表所示元素中能形成氢化物且氢化物分子间存在氢键最强的是(填氢化物的分子式) 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____价;与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。CH3OH的熔、沸点比CH4的熔、沸点高,其主要原因是 ______。
(4)根据VSEPR理论预测NG4- 离子的空间构型为__________型。E、F、G、N原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为:__________(任意一种)。
查看答案和解析>>
科目:高中化学 来源:2010年吉林省东北师大附中高二下学期期中考试化学试题 题型:填空题
【化学-选修物质结构与性质】(共12分)
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A | | | |||||||||||||||
| B | C | | D | E | F | G | H | I | |||||||||
| J | K | | | | M | N | | ||||||||||
| | | | | | | | Fe | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:2012届上海市崇明县高三高考模拟考试(二模)化学试卷(带解析) 题型:填空题
(共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| | IA | | | | | | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | |
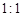 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。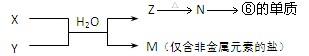
 。
。查看答案和解析>>
科目:高中化学 来源:2010年吉林省高二下学期期中考试化学试题 题型:填空题
【化学-选修物质结构与性质】(共12分)
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
|
|||||||||||||||
|
B |
C |
|
D |
E |
F |
G |
H |
I |
|||||||||
|
J |
K |
|
|
|
M |
N |
|
||||||||||
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
|
|
试依据信息回答下列问题:
(1)上表所示元素中能形成氢化物且氢化物分子间存在氢键最强的是(填氢化物的分子式) 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____价;与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。CH3OH的熔、沸点比CH4的熔、沸点高,其主要原因是 ______。
(4)根据VSEPR理论预测NG4- 离子的空间构型为__________型。E、F、G、N原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为:__________(任意一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com