
| A.制备Fe(OH)3胶体时,应往沸水中滴加饱和FeCl3溶液,并继续加热到溶液呈红褐色为止。 |
| B.测定中和热实验中,每次实验均应测量三个温度,即盐酸起始温度,NaOH溶液的起始温度和反应后溶液的最高温度。 |
| C.在一定物质的量溶液配制的过程中,没有洗涤烧杯和玻璃棒、定容时加水超过了刻度线、容量瓶没有干燥均会使所配溶液浓度偏低。 |
| D.往FeCl3溶液中滴入KI—淀粉溶液,溶液变蓝色。 |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.SO2使品红褪色的机理和使酸性KMnO4褪色的机理一样 |
| B.蛋白质溶液和蔗糖溶液可以用丁达尔现象来区别,因为分散质颗粒大小不同 |
| C.将BaSO4投入饱和Na2CO3溶液,能生成BaCO3,据此可确定Ksp(BaCO3)< Ksp(BaSO4 |
| D.(NH4)2CO3(s)=NH4HCO3(s) +NH3(g)△H>0在室温下能自发,因为体系熵值增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
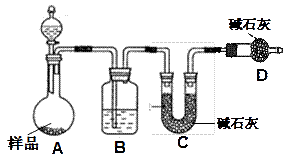
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。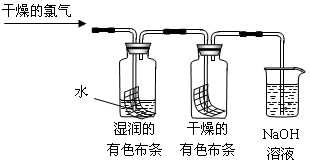
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
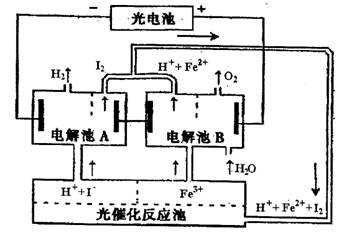
|
| A.设计该循环系统的目的是制取I2 | B.电解池A中离子反应方程式: |
C.光催化反应池中离子反应方程式为: | |
| D.该系统中的Fe3+、H2O、I-都是循环使用的物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 实验步骤 | 实验现象 |
| Ⅰ | 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。充分反应后,过滤。 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| Ⅱ | 滤液中加入少量的NaOH溶液。 | 有白色沉淀产生。 |
| Ⅲ | 将所得红色固体用蒸馏水洗涤后,加热烘干。 | 少量红色固体变黑 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.取Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒回试剂瓶中。 |
| B.将剩余的金属钠放回原盛放金属钠的试剂瓶中。 |
| C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部蒸干才停止加热。 |
| D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
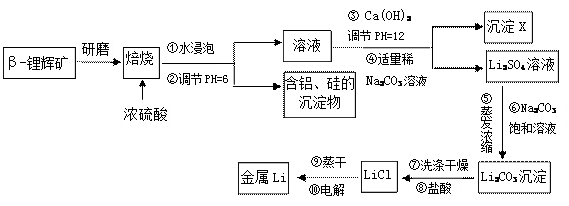
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com