
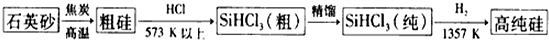
分析 (1)SiHCl3与氢气反应生成硅和氯化氢;
(2)A.岩石和矿物的基本元素有硅元素;
B.水晶主要成分是二氧化硅,是氧化物;
C.光导纤维主要成分二氧化硅;
D.陶瓷的主要原料是黏土,则陶瓷是人类应用很早的硅酸盐材料.
(3)硅酸钠与盐酸反应生成硅酸和氯化钠,硅酸为白色胶状固体,据此解答.
解答 解:(1)SiHCl3与氢气反应生成硅和氯化氢,方程式:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
(2)A.岩石和矿物中含有硅酸盐、二氧化硅,所以岩石和矿物的基本元素有硅元素,故A正确;
B.水晶主要成分是二氧化硅,是氧化物,不是硅酸盐,故B错误;
C.二氧化硅广泛用于制作光导纤维,故C错误;
D.陶瓷的主要原料是黏土,则陶瓷是人类应用很早的硅酸盐材料,故D正确;
故选:AD;(3)硅酸钠与盐酸反应生成硅酸和氯化钠,方程式:Na2SiO 3+2HCl═H2 SiO 3↓+2NaCl,硅酸为白色胶状固体,所以会看到试管中有白色胶状沉淀生成;
故答案为:试管中有白色胶状沉淀生成;
Na2SiO 3+2HCl═H2 SiO 3↓+2NaCl;
点评 本题考查了硅及其化合物,涉及硅的制备与提纯,硅、二氧化硅的用途,明确相关物质的性质是解题关键,题目难度不大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠的密度比乙醇的大 | |
| B. | 乙醇分子中6个氢原子的化学性质完全相同 | |
| C. | 钠与乙醇的反应比钠与水的反应缓和 | |
| D. | 钠与乙醇反应产生的气体可以燃烧,燃烧前必须验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | KOH(aq)+HNO3(aq)═KNO3+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
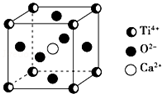 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为236 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电作用力形成的化学键,叫离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中不一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
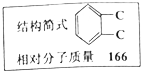 实验室有一试剂瓶的标签严重破损,只能隐约看到如图所示部分,取该试剂瓶中的试剂,通过燃烧实验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9gH2O.
实验室有一试剂瓶的标签严重破损,只能隐约看到如图所示部分,取该试剂瓶中的试剂,通过燃烧实验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9gH2O.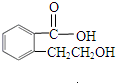 ;
; .
.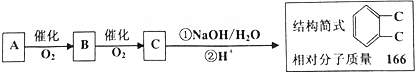
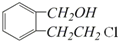 ;
;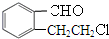 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2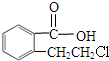 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com