
| A. | 溴苯和水 | B. | 乙酸和水 | C. | 酒精和水 | D. | 硝基苯和苯 |
科目:高中化学 来源: 题型:解答题
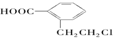 ,A在一定条件下有如图所示的转化关系.已知E分子式为C9H8O2.
,A在一定条件下有如图所示的转化关系.已知E分子式为C9H8O2.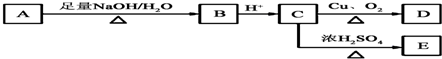
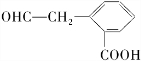 ,若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F,欲由A通过一步反应得到F,该反应的化学方程式是
,若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F,欲由A通过一步反应得到F,该反应的化学方程式是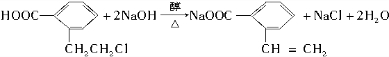 .
. ,写出所有符合下列要求的E的同分异构体的结构简式:
,写出所有符合下列要求的E的同分异构体的结构简式: 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4++OH-;实验室制备A的氢化物的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.
NH4++OH-;实验室制备A的氢化物的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
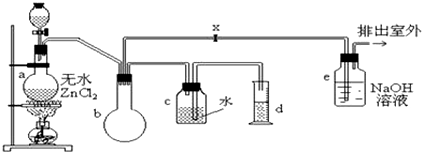
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,系统命名法命名为2,2,4,4-四甲基戊烷
,系统命名法命名为2,2,4,4-四甲基戊烷 ,系统命名法命名为2,2,3,3-四甲基戊烷
,系统命名法命名为2,2,3,3-四甲基戊烷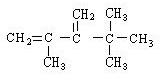 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-n-3 | B. | a+n+3 | C. | a+n-3 | D. | a-n+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com