
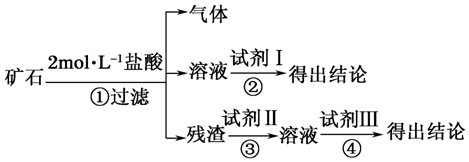
| 编号 | 实验操作 | 预期现象与结论 |
| ① | 取适量矿石研细,加足量2mol•L-1盐酸 | 有大量无色气体产生,得棕黄色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | 取①操作残余固体适量置于烧杯,加入足量2mol•L-1NaOH溶液,充分搅拌 | 残余固体完全溶解于2mol•L-1NaOH溶液,并得无色溶液 |
| ④ |
分析 矿石部分溶解,并有大量无色无味气体生成,则一定含CaCO3、SiO2,如检验是否含有Fe2O3,可在反应后的溶液中加入KSCN溶液,残渣加入氢氧化钠溶液,SiO2与NaOH反应,与盐酸不反应,硅酸盐与盐酸反应生成白色的硅酸沉淀,
(1)Fe2O3可溶于盐酸,Fe3+存在于溶液中,可用SCN-检验,从而说明矿石含Fe2O3.SiO2不溶于盐酸,作为残渣被滤出,是否存在SiO2,加入NaOH溶液,充分反应后,再加盐酸,如果生成了白色胶状沉淀检验二氧化硅的存在;
(2)检验矿石中含有Fe2O3,与盐酸反应生成氯化铁,取少量上述流程中的Ⅰ,加入2%KSCN溶液,溶液变为血红色,则含有氧化铁,
检验是否含有二氧化硅,取①操作得残余固体适量置于烧杯中,加入足量2 mol•L-1NaOH溶液,充分搅拌,残余固体完全溶解于2 mol•L-1NaOH溶液,并得无色溶液,
然后取③操作得无色溶液少许置于洁净试管中,用胶头滴管滴入2 mol•L-1盐酸至过量,有白色胶状沉淀;
解答 解:(1)Fe2O3可溶于盐酸,Fe3+存在于溶液中,可用SCN-检验,从而说明矿石含Fe2O3.SiO2不溶于盐酸,作为残渣被滤出.为进一步确认,是否存在SiO2,加入NaOH溶液,充分反应后,再加盐酸,如果生成了白色胶状沉淀则其为H2SiO3,说明矿石中有SiO2,
故答案为:2%的KSCN溶液;2 mol•L-1 NaOH溶液;2 mol•L-1盐酸;
(2)检验矿石中含有Fe2O3,与盐酸反应生成氯化铁,取少量上述流程中的Ⅰ,加入2%KSCN溶液,溶液变为血红色,则含有氧化铁,
检验是否含有二氧化硅,取①操作得残余固体适量置于烧杯中,加入足量2 mol•L-1NaOH溶液,充分搅拌,残余固体完全溶解于2 mol•L-1NaOH溶液,并得无色溶液,
然后取③操作得无色溶液少许置于洁净试管中,用胶头滴管滴入2 mol•L-1盐酸至过量,有白色胶状沉淀,且不溶于过量盐酸,可说明含有二氧化硅,
故答案为:
| ② | 取①操作得溶液少许置于洁净试管中,并滴加几滴2%的KSCN溶液 | 溶液变为红色,说明原矿石可能含有Fe2O3 |
| ④ | 取③操作得无色溶液少许置于洁净试管中,用胶头滴管滴入2 mol•L-1盐酸至过量 | 有白色胶状沉淀,且不溶于过量盐酸,说明原矿石中可能含有SiO2 |
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质及实验中发生的反应为解答的关键,注意现象与结论的分析,侧重分析与实验能力的考查,题目难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 中子数为10的氧原子:810O | B. | 氧负离子(O2-)的结构示意图: | ||
| C. | Na2O2的电子式: | D. | 1-丙醇的结构简式: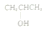 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A12O3属于两性氧化物 | |
| B. | 两步反应中CO均是氧化产物 | |
| C. | Al4C3与盐酸反应可生成烃,该烃为乙烯 | |
| D. | 生成的铝粉不能在空气中冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第四周期中的 18 种元素具有重要的用途.
第四周期中的 18 种元素具有重要的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AgNO3溶液滴入集气瓶中,观察是否生成白色沉淀 | |
| B. | 用手将湿润的淀粉碘化钾试纸放在集气瓶上方,观察试纸是否变蓝 | |
| C. | 将湿润的淀粉碘化钾试纸粘在玻棒一端,伸到集气瓶口,观察试纸是否变蓝 | |
| D. | 将紫色石蕊试液滴入集气瓶中,观察试液是否先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com