
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=0.1mol/(L•s) | D. | υ(D)=0.4mol/(L•min) |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$不变 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 传统的节日和纪念日,从中央到地方都应该多举办形式华丽、场面壮观的大型庆典活动,贫困地区可以靠拉赞助、贷款、摊派等形式筹集相关费用 | |
| B. | 不囤东西,不买便宜次品货,确有必要的东西,买好的,并充分使用它 | |
| C. | 精简银行卡,仅保留一张借记卡一张信用卡 | |
| D. | 用电脑写东西,少用纸,养成纸质文件扫描、存档的习惯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 方案 | 操作 | 判断 |
| A | 分别加入澄清石灰水 | 产生沉淀者为Na2CO3 |
| B | 分别加入等浓度的稀盐酸 | 反应较剧烈者为Na2CO3 |
| C | 分别加入CaCl2溶液 | 产生沉淀者为Na2CO3 |
| D | 逐渐加入等浓度的盐酸 | 立即产生气泡者为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
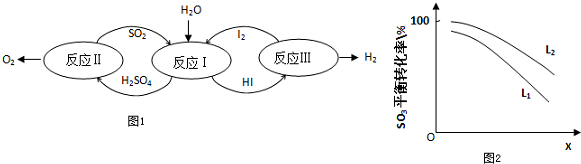
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
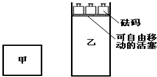 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图).关于两容器中反应的说法正确的是( )| A. | 两容器达平衡后升高相同的温度时,甲容器的反应速率大于乙容器的速率 | |
| B. | 两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的密度不同 | |
| C. | 甲容器中的反应先达到化学平衡状态 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的物质的量是乙中物质C的物质的量的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com