
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2011年高考化学总复习30分钟限时训练:专题12 化学与自然资源的开发利用 题型:058
海洋中含有丰富的资源,是人类的巨大宝库.我国拥有很长的海岸线,东部沿岸海滩平缓,多细沙,日照时间长,不少盐场均集中于此.回答下列问题:
(1)制海盐方法如下:海水涨潮时,将海水引入盐田,等落潮时,再用日晒的方法,待盐田水分蒸发到一定程度时,再撒入食盐颗粒(称为晶种),食盐晶体即从饱和溶液中析出.请说明盐田获得食盐晶体的条件________.
(2)以食盐为主要原料可以制备纯碱.试用化学方程式表示其制备过程:
________.
此法制得的纯碱中常含有少量氯化钠,要测定样品中的纯碱的质量分数,还可采用下图中的装置进行实验:
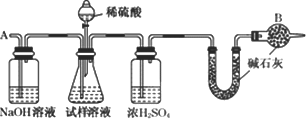
请你用一句话叙述该实验设计的基本原理:________.
(3)氯碱化工厂制得的烧碱中也含有少量氯化钠(假设不含其他杂质),用中和滴定法设计一个实验方案以测定样品中烧碱和氯化钠的质量分数.试剂是0.100 0 mol/L盐酸、酚酞溶液,仪器是50 mL的酸式滴定管、锥形瓶.其实验的主要步骤是________、________、滴定.
(4)工业上用电解法制备金属钠,但制备金属钾一般不采用电解熔融氯化钾,而是采用热还原法来制备.在850℃用金属钠来还原KCl反应如下:
Na(液)+KCl(液)![]() NaCl(液)+K(气).
NaCl(液)+K(气).
工业上应采用哪些措施才能使反应向正反应方向移动?
________.
查看答案和解析>>
科目:高中化学 来源:2010年江苏省徐州市高三第三次调研考试(化学试题) 题型:填空题
重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为
03,还含有FeO、A1203、Si02等杂质)为原料制取重铬酸钠的流程如下:
请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为 。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAl02
的溶液)pH的目的是 。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了
Na2Cr04转化为Na2Cr207的生产,其原理如下图所示。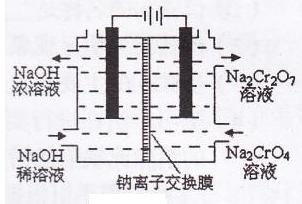
①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被
氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入cl mol/L。的
Na2Cr207溶液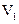 mL,使水中的还原性物质完全被氧化(还原产物为
mL,使水中的还原性物质完全被氧化(还原产物为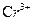 );再用
);再用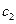
 的FeS04溶液滴定剩余的
的FeS04溶液滴定剩余的 ,结果消耗FeS04溶液
,结果消耗FeS04溶液 mL。则该水
mL。则该水
样的COD为 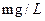 。
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省深圳市南山区高三上学期期末考试化学试卷(解析版) 题型:填空题
铬及其化合物在现代工业上的应用广泛,可用于电镀,鞣制羊毛,皮革;铬还用于照相材料,胶版印刷及化工触媒剂等。但化工废料铬渣对人体健康有很大危害。
Ⅰ:某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
|
阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
|
开始沉淀时的pH |
1.9 |
7.0 |
—— |
—— |
4.7 |
—— |
|
沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9 (>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施是 (至少答一点)。
(3)调节溶液的pH=8是为了除去 离子。钠离子交换树脂的原理为:
Mn++nNaR→MRn+nNa+,被交换的的杂质离子是 。
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH) 的溶度积Ksp= c(Cr3+)• c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
。
的溶度积Ksp= c(Cr3+)• c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
。
(5)还原过程发生以下反应(请配平): Na2Cr2O7+ SO2+
= Cr(OH) (H2O)5SO4+ Na2SO4;
Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。
其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe做电极的原因为
在阴极附近溶液pH升高的原因是(用电极反应解释) 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

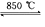 NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________
NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________ 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com