
【题目】实验室采用HCl气体“置换”除水,升华相结合的方法从市售的氯化锌制备高纯度无水氯化锌,装置如图所示[市售氯化锌含Zn(OH)Cl]。下列说法不正确的是

A. 恒压漏斗的作用是平衡气体压强
B. 管式炉Ⅰ采取的升温方式是阶段式升温
C. 实验时,应先撒去管式炉Ⅰ,再撤去管式炉Ⅱ
D. 在尾气吸收装置前应增加一个干燥装置
【答案】C
【解析】A项,恒压分液漏斗可以保证内部压强不变,保持恒压分液漏斗与三颈瓶内压强相等,使浓硫酸顺利滴下,故A正确;B项,装置中干燥的HCl气体从左边进入管式炉I,与Zn(OH)Cl反应生成氯化锌和H2O(g),H2O(g)随HCl气流进入尾气吸收装置,然后管式炉I升至更高的温度使氯化锌升华进入管式炉II,凝华得到高纯度无水氯化锌,所以管式炉Ⅰ采取的升温方式是阶段式升温,故B正确;C项,氯化锌升华进入管式炉II,凝华得到高纯度无水氯化锌,所以实验时应先撤去管式炉Ⅱ的加热,再撒去管式炉Ⅰ,故C错误;D项,为防止氯化锌吸水再次生成Zn(OH)Cl,在尾气吸收装置前应增加一个干燥装置,故D正确。


科目:高中化学 来源: 题型:
【题目】下列属于分子晶体的一组物质是( )
A. CaO、NO、CO B. CCl4、H2O、He
C. CO2、SO2、NaCl D. CH4、O2、Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧热的热化学方程式为________(填选项字母)。
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9 kJ·mol-1
B.H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2O+O2=2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+![]() O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+________![]() ________+________
________+________
④2HgO![]() 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:_____________;请根据“绿色化学”的思想评估该方法制H2的主要缺点:___________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。

请写出化学方程式:
反应①__________________________。
反应②__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由 图分析不能得出的结论是( )

A. a是反应物
B. 正反应是一个体积扩大的反应
C. 若升高温度,a的转化率增大
D. 若增大压强,a的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料转化成葡萄糖内酯并获得能量。下列说法正确的是( )

A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极的电极反成为:MnO2+2H2O+2e-=Mn2++4OH-
D. 当消耗0.01mol葡萄糖时,电路中转移0.02mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积固定的密闭容器中发生可逆反应:A (g)+2B (g)![]() C (s)+D (g),能说明反应已达到平衡状态的事实是
C (s)+D (g),能说明反应已达到平衡状态的事实是
A. 容器内A、B、C、D四者共存 B. νA(正)=2νB(逆)
C. 容器内各种物质的浓度不再改变 D. νA(正)=νC(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入少量无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到乙试管中有明显现象时停止实验。试回答:

(1)试管乙中观察到的现象是______________________。
(2)液体混合加热时液体容积不能超过其容积_____,本实验反应开始时用小火加热的原因是__________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(3)试管甲中加入浓硫酸的目的是__________。
(4)该实验中长导管的作用是_______,其不宜伸入试管乙的溶液中,原因是________。
(5)试管乙中饱和Na2CO3的作用是______________________________________。
(6)写出试管甲中发生反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生物电化学方法脱除水体中NH4+的原理如下图所示:
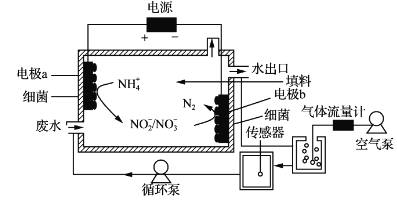
下列说法正确的是
A. 装置工作时,化学能转变为电能
B. 装置工作时,a极周围溶液pH降低
C. 装置内工作温度越高。NH4+脱除率一定越大
D. 电极b上发生的反应之一是:2NO3--2e-=N2↑+3O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com