
【题目】一定量混合气体在密闭容器中发生如下反应![]() ;ΔH <0,达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3 mol·L-1。则下列叙述正确的是( )
;ΔH <0,达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3 mol·L-1。则下列叙述正确的是( )
A. 平衡向右移动 B. x+y>z C. B的转化率提高 D. C的体积分数增加
科目:高中化学 来源: 题型:
【题目】在硫酸铜晶体结晶水含量测定的实验中,会造成实验结果偏低的是( )
A. 加热时间过长,固体部分变黑B. 坩埚内附有不挥发杂质
C. 晶体不纯,含有不挥发杂质D. 加热过程中有少量晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和生活中有着重要的作用。下列有关说法不正确的是( )
A. 焊接金属时常用![]() 溶液做除锈剂
溶液做除锈剂
B. 嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料
C. 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂
D. PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.完成下列制备物质的化学方程式:以电石、水、食盐为原料制备PVC____________________
II.由丁炔二醇制取1,3-丁二烯,请根据下面的合成路线图填空:
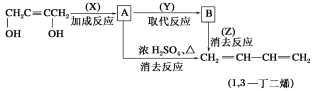
(1)写出各反应的反应条件及试剂名称:X________;Y________;Z________。
(2)写出A、B的结构简式:A____________;B____________。
III.下列物质在水中可能存在化合物甲、乙、丙有如下转化关系:
甲(C4H10O)条件条件①→乙(C4H8)![]() 丙(C4H8Br2)回答:
丙(C4H8Br2)回答:
(1)甲中官能团的名称是________,甲属________类物质,甲可能结构有________种,其中可催化氧化为醛的有________种。
(2)反应条件①为______________,条件②为______________。
(3)甲→乙的反应类型为____________,乙→丙的反应类型为____________。
(4)丙的结构简式不可能是________。
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
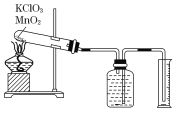
实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g.
②连接好实验装置,检查装置的气密性.
③加热,开始反应,直到不再有气体产生为止.
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL.
⑤准确称量试管和残留物的质量为15.55 g.
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?______________________________________________。
(2)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同
②使试管和广口瓶内气体都冷却至室温
③读取量筒内液体的体积
这三步操作的正确顺序是________(请填写步骤代码。进行③的实验操作时,若仰视读数,则读取氧气的体积________(填“偏大”、“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是________mol;实验测得氧气的摩尔体积是________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
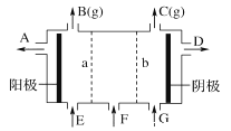
A. 阴极反应式为4OH--4e-=2H2O+O2↑
B. 从A口出来的是NaOH溶液
C. b是阳离子交换膜,允许Na+通过
D. Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有NH![]() 、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、I-、Cl-,取该溶液进行以下实验:
、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、I-、Cl-,取该溶液进行以下实验:
①用pH试纸测得该溶液呈酸性;
②取部分溶液,加入数滴新制的氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,在整个滴加过程中无沉淀生成;
④取部分上述碱性溶液,加入Na2CO3溶液,有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实回答问题:
(1)写出②所发生反应的离子方程式_________。
(2)该溶液中肯定存在的离子是________。
(3)该溶液中肯定不存在的离子是________。
(4)该溶液中还不能确定是否存在的离子是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中进行的反应N2+O2![]() 2NO,下列条件能加快其反应速率的是( )
2NO,下列条件能加快其反应速率的是( )
A.增大体积使压强减小
B.体积不变,充入N2使压强增大
C.体积不变,充入He使压强增大
D.压强不变,充入气体Ne
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
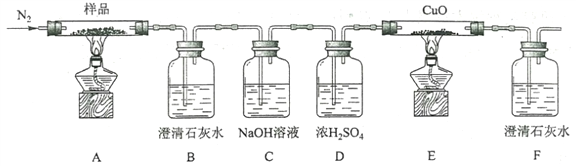
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com