
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式______________,A的结构简式_______________;
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式___________,反应类型______________;
(3)在碘水中加入B振荡静置后的现象 __________________________________;
(4)B与Br2在FeBr3催化下反应的化学反应方程式_________________________,反应类型___________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量____________(填“A>B”或“A<B”或“A=B”)。
【答案】![]() CH2=CH2 CH3CH=CH2+Br2→CH2BrCHBrCH3 加成反应 下层无色,上层紫红色
CH2=CH2 CH3CH=CH2+Br2→CH2BrCHBrCH3 加成反应 下层无色,上层紫红色  取代反应 A>B
取代反应 A>B
【解析】
A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,则原子个数之比为1:1,若符合CnH2n-6,B的相对分子质量为78,则12n+2n-6=78,解得n=6,所以B为苯。据此解答。
(1)根据上述分析,A为乙烯,电子式为![]() ,结构简式为CH2=CH2。
,结构简式为CH2=CH2。
(2)A相邻的同系物C为CH2=CHCH3,使溴的CCl4溶液水褪色发生加成反应,该反应为CH3CH=CH2 +Br2→CH2BrCHBrCH3,反应类型为加成反应。
(3)碘水中加入苯发生萃取,苯的密度比水的小,则苯在上层,观察到分层 ,下层几乎无色,上层紫红色。
(4)B与Br2在FeBr3催化下发生取代反应生成溴苯和水,反应的化学反应方程式为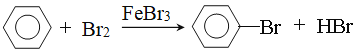 。
。
(5)A为乙烯,B为苯,设A、B的质量均为m,由CxHy消耗(x+y/4)氧气可知,乙烯消耗氧气为3×m÷28=3m/28,苯消耗氧气为7.5×m÷78=5m/52,则等质量的A、B完全燃烧时消耗O2的物质的量A>B。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】若某原子 X 的原子序数为 26,则下列叙述不正确的是( )
A.X 是金属元素B.X 外围电子排布式是 3d64s2
C.X 是 d 区元素D.X 在周期表中位于第四周期,第Ⅷ B 族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A. 肯定有SO2和NO
B. 肯定没有Cl2、O2和NO2
C. 可能有Cl2和O2
D. 肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )

A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
C. 每消耗1molX同时生成2mol Z,说明反应已达平衡
D. 反应开始到10s时,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知20.0g NaOH溶于水配成稀溶液与足量的盐酸反应,放出28.8kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量______ kJ,由此测得的中和热为_____kJ/mol;
(2)已知断开1mol H—H键、1mol Br—Br键、1mol H—Br键分别需吸收的能量为436kJ、193kJ、366kJ。计算H2和Br2反应生成1mol HBr需 _______(填“吸收”或“放出”)能量_________ kJ;
(3)t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
2SO3(g),2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
①从反应开始到化学平衡,生成SO3的平均反应速率为____________________ ,平衡时SO2的转化率为__________;
②下列叙述能证明该反应已达到化学平衡状态的是__________(填标号)。
A. 容器内压强不再发生变化
B. SO2的体积分数不再发生变化
C. 容器内气体原子总数不再发生变化
D. 相同时间内消耗2n mol SO2的同时消耗n mol O2
E. 相同时间内消耗2n mol SO2的同时生成n mol O2
③t2℃时,若将物质的量之比n(SO2):n(O2) = 1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)![]() 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g,该混合气体可能是( )
A. 乙烷和乙烯 B. 乙烷和乙烯 C. 甲烷和乙烯 D. 甲烷和丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可绕键轴自由旋转,某烃的结构简式如下图所示,下列说法中正确的是
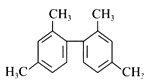
A. 该物质所有原子均可共面
B. 分子中至少有10个碳原子处于同一平面上
C. 分子中至少有11个碳原子处于同一平面上
D. 该烃与苯互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com