
| ÖÜĘŚ ×å | ¢ńA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | 0 |
| 2 | N | O | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 £»
£»·ÖĪö £Ø1£©Ķ¬Ņ»ÖÜĘŚ£¬Ō×ÓŠņŹżŌ½“󣬷Ē½šŹōŠŌŌ½Ē棬Ķ¬Ņ»Ö÷×壬µē×Ó²ćŹżŌ½Š”£¬·Ē½šŹōŠŌŌ½Ē棻
£Ø2£©NeĪŖ10µē×ÓŌ×Ó£¬ÓŠ2øöµē×Ó²ć£¬¾Ż“Ė½ā“š£»
£Ø3£©Ķ¬Ņ»ÖÜĘŚ£¬Ō×ÓŠņŹżŌ½Š”£¬°ė¾¶Ō½“ó£»
£Ø4£©ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬Ęä¶ŌÓ¦Ēā»ÆĪļŌ½ĪČ¶Ø£»
£Ø5£©ĀĮµÄŃõ»ÆĪļŹōÓŚĮ½ŠŌŃõ»ÆĪļ£¬¾Ż“Ė½ā“š¼“æÉ£»
£Ø6£©ŌŖĖŲµÄ½šŹōŠŌŌ½Ē棬Ęä¶ŌÓ¦×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄ¼īŠŌŌ½Ē棻
£Ø7£©¶žŃõ»Æ¹čÓ¦ÓĆÓŚ¹āµ¼ĻĖĪ¬£»
£Ø8£©¹żŃõ»ÆĒāŹĒÓÉOŗĶH¹¹³ÉµÄ»ÆŗĻĪļ£¬¾Ż“Ė½ā“š£»
£Ø9£©ĀČ»ÆĆ¾µē½āÉś³ÉĆ¾ŗĶĀČĘų£¬¾Ż“Ė½ā“š¼“æÉ£®
½ā“š ½ā£ŗ£Ø1£©Ķ¬Ņ»ÖÜĘŚ£¬“Ó×óµ½ÓŅ£¬·Ē½šŹōŠŌŌöĒ棬Ķ¬Ņ»Ö÷×壬“ÓĻĀµ½ÉĻ£¬·Ē½šŹōŠŌŌöĒ棬ŌŚÕāŠ©ŌŖĖŲÖŠ£¬·Ē½šŹōŠŌ×īĒæµÄŹĒF£¬¹Ź“š°øĪŖ£ŗF£»
£Ø2£©NeµÄŌ×ÓŠņŹżĪŖ10£¬×īĶā²ć“ļµ½ĮĖ8øöµē×ÓµÄĪČ¶Ø½į¹¹£¬ĘäŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ£ŗ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£»
£Ø3£©µē×Ó²ćŹżŅ»ŃłµÄŌŖĖŲ£¬Ō×ÓŠņŹżŌ½Š”£¬°ė¾¶Ō½“󣬹ŹNÓėO±Č£¬OµÄ°ė¾¶Š”£¬¹Ź“š°øĪŖ£ŗO£»
£Ø4£©ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬Ęä¶ŌÓ¦Ēā»ÆĪļŌ½ĪČ¶Ø£¬ÓÉÓŚ·Ē½šŹōŠŌCl£¾S£¬¹ŹĪČ¶ØŠŌŗƵďĒ£ŗHCl£¬¹Ź“š°øĪŖ£ŗHCl£»
£Ø5£©Ńõ»ÆĀĮ¼ČÄÜÓėĖį·“Ó¦£¬Ņ²ÄÜÓė¼ī·“Ó¦£¬ŹōÓŚĮ½ŠŌŃõ»ÆĪļ£¬¹Ź“š°øĪŖ£ŗAl2O3£»
£Ø6£©ŌŖĖŲµÄ½šŹōŠŌŌ½Ē棬Ęä×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļµÄ¼īŠŌŌ½Ē棬ÓÉÓŚ½šŹōŠŌNa×īĒ棬¹Ź×īĒæµÄ¼īŹĒNaOH£¬¹Ź“š°øĪŖ£ŗNaOH£»
£Ø7£©¶žŃõ»Æ¹č³£ÓĆ×÷¹āµ¼ĻĖĪ¬£¬¹Ź“š°øĪŖ£ŗ¹āµ¼ĻĖĪ¬£»
£Ø8£©¹żŃõ»ÆĒāÓÖ½Š×öĖ«ŃõĖ®£¬¾Ż“ĖµĆ³öĘä»ÆѧŹ½ĪŖ£ŗH2O2£¬ĘäÖŠHµÄÖŹĮæĪŖ1”Į2=2£¬OµÄÖŹĮæĪŖ2”Į16=32£¬Į½ÕߵıČÖµĪŖ2£ŗ32=1£ŗ16£¬¹Ź“š°øĪŖ£ŗH2O2£»1£ŗ16£»£Ø9£©µē½āČŪČŚµÄĀČ»ÆĆ¾µĆµ½Ć¾µ„ÖŹŗĶĀČĘų£¬»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗMgCl2£ØČŪČŚ£©$\frac{\underline{\;Ķصē\;}}{\;}$Mg+Cl2£¬¹Ź“š°øĪŖ£ŗMgCl2£ØČŪČŚ£©$\frac{\underline{\;Ķصē\;}}{\;}$Mg+Cl2£®
µćĘĄ ±¾Ģāæ¼²éŌŖĖŲÖÜĘŚ±ķÓėŌŖĖŲÖÜĘŚĀÉ£¬ŠčŅŖѧɜŹģĮ·ÕĘĪÕŌŖĖŲÖÜĘŚ±ķ£¬ÓŠĄūÓŚ»ł“”ÖŖŹ¶µÄ¹®¹Ģ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 øĆĪļÖŹÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«£¬ŌŚÕāøö·“Ó¦ÖŠĢåĻÖĮĖøĆĪļÖŹµÄ»¹ŌŠŌ£ØĢī”°Ńõ»ÆŠŌ”±»ņ”°»¹ŌŠŌ”±£©£®
øĆĪļÖŹÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«£¬ŌŚÕāøö·“Ó¦ÖŠĢåĻÖĮĖøĆĪļÖŹµÄ»¹ŌŠŌ£ØĢī”°Ńõ»ÆŠŌ”±»ņ”°»¹ŌŠŌ”±£©£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
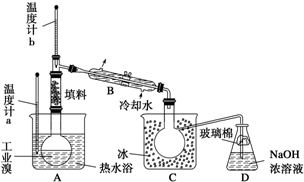 ij»Æѧъ¾æŠŌѧĻ°Š”×éĪŖĮĖ½ā“Ó¹¤ŅµäåÖŠĢį“æäåµÄ·½·Ø£¬²éŌÄĮĖÓŠ¹Ų׏ĮĻ£¬Br2µÄ·ŠµćĪŖ59”ę£¬Ī¢ČÜÓŚĖ®£¬ÓŠ¶¾ŠŌŗĶĒæøÆŹ“ŠŌ£®ĖūĆĒ²Ī¹ŪÉś²ś¹ż³Ģŗó£¬×é×°ĮĖČēĶ¼×°ÖĆ¼ņĶ¼£ŗ
ij»Æѧъ¾æŠŌѧĻ°Š”×éĪŖĮĖ½ā“Ó¹¤ŅµäåÖŠĢį“æäåµÄ·½·Ø£¬²éŌÄĮĖÓŠ¹Ų׏ĮĻ£¬Br2µÄ·ŠµćĪŖ59”ę£¬Ī¢ČÜÓŚĖ®£¬ÓŠ¶¾ŠŌŗĶĒæøÆŹ“ŠŌ£®ĖūĆĒ²Ī¹ŪÉś²ś¹ż³Ģŗó£¬×é×°ĮĖČēĶ¼×°ÖĆ¼ņĶ¼£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź¹pHŹŌÖ½±äŗģµÄČÜŅŗ£ŗK+”¢Ca2+”¢Cl-”¢ClO- | |
| B£® | ĪŽÉ«ĶøĆ÷µÄČÜŅŗ£ŗCu2+”¢NH4+”¢NO3-”¢CO32- | |
| C£® | 0.1 mol•L-1KNO3ČÜŅŗ£ŗMg2+”¢Fe3+”¢Cl-”¢SO42- | |
| D£® | Ė®µēĄė³öµÄc£ØH+£©=10-12 mol•L-1µÄČÜŅŗ£ŗNa+”¢NH4+”¢SO42-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 7.8g ±½ÖŠŗ¬ÓŠµÄµ„¼üŹżÄæĪŖ0.9NA | |
| B£® | 1 mol Cl2ČÜÓŚĖ®£¬ÓėĖ®·“Ó¦Ź±µē×Ó×ŖŅĘŹżÄæĪŖ1 NA | |
| C£® | ŌŚ298K 1.01”Į105paĻĀ£¬22 g CO2ŗĶN2O»ģŗĻĘųĢåÖŠ£¬ĖłÕ¼µÄĢå»ż“óÓŚ11.2Éż | |
| D£® | ³£ĪĀĻĀ£¬pH=13µÄNaOHČÜŅŗÖŠŗ¬ÓŠµÄOH-Ąė×ÓŹżÄæĪŖ0.1NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘĻĢŃĢĒ”¢ÕįĢĒ”¢ÓĶÖ¬ŗĶµ°°×ÖŹŌŚŅ»¶ØĢõ¼žĻĀ¶¼ÄÜĖ®½ā | |
| B£® | µČÖŹĮæµÄ¼×Ķ锢ŅŅĻ©”¢1£¬3-¶”¶žĻ©£ØC4H6£©·Ö±šŌŚæÕĘųÖŠ³ä·ÖČ¼ÉÕ£¬ĖłŗÄÓĆŃõĘųµÄĮæŅĄ“ĪŌö“ó | |
| C£® | ²»ÓĆČĪŗĪŹŌ¼ĮŗĶŅĒĘ÷æɼų±šŅŅ“¼”¢ŅŅĖį”¢ŅŅĖįŅŅõ„”¢±½ĖÄÖÖÓŠ»śĪļ | |
| D£® | Čō¼×ĶéÓėĀČĘųŅŌĪļÖŹµÄĮæÖ®±Č1£ŗ3»ģŗĻ£¬ŌŚ¹āÕÕĻĀµĆµ½µÄ²śĪļÖ»ÓŠCHCl3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬ĻąĶ¬Ģå»żµÄČĪŗĪĪļÖŹ£¬ĘäĪļÖŹµÄĮæ±ŲĻąµČ | |
| B£® | ĻąĶ¬Ģõ¼žĻĀµÄŅ»Ńõ»ÆĢ¼ĘųĢåŗĶµŖĘų£¬ČōĢå»żĻąµČ£¬ŌņÖŹĮæŅ²ĻąµČ | |
| C£® | ²»Ķ¬µÄĘųĢ壬ČōĢå»ż²»Ķ¬£¬ŌņĖüĆĒĖłŗ¬µÄ·Ö×ÓŹżŅ²²»Ķ¬ | |
| D£® | ŌŚ²»Ķ¬Ģõ¼žĻĀ£¬µČĪļÖŹµÄĮæµÄ¼×ĶéŗĶŅ»Ńõ»ÆĢ¼Ėłŗ¬µÄ·Ö×ÓŹżŅ»¶Ø²»µČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 50mL 0.5mol/LµÄŃĪĖįÓė50mL0.55mol/LµÄNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖć·“Ó¦ČČ£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
50mL 0.5mol/LµÄŃĪĖįÓė50mL0.55mol/LµÄNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖć·“Ó¦ČČ£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com