
【题目】室温下的四种溶液:①pH=9的 NaOH 溶液 ②pH=9的CH3COONa溶液 ③pH=5的H2SO4溶液 ④pH=5的NaHSO4 溶液,溶液中由水电离产生的c(OH-)相同的是( )
A.①②B.①③C.③④D.①③④
【答案】D
【解析】
①pH=9的NaOH溶液,c(H+)=1.0×109molL1;![]() ,碱溶液中c(H+)是由水电离产生的,水电离产生的c(H+)等于水电离产生的c(OH-),即水电离产生的c(OH-)=1.0×109molL1;
,碱溶液中c(H+)是由水电离产生的,水电离产生的c(H+)等于水电离产生的c(OH-),即水电离产生的c(OH-)=1.0×109molL1;
②pH=9的CH3COONa溶液c(H+)=1.0×109molL1;![]() ,盐溶液水解显碱性,因此溶液中的c(OH-)是由水电离产生的,即水电离产生的c(OH-)=1.0×105molL1;
,盐溶液水解显碱性,因此溶液中的c(OH-)是由水电离产生的,即水电离产生的c(OH-)=1.0×105molL1;
③pH=5的H2SO4溶液,c(H+)=1.0×105molL1;![]() ,酸溶液中c(OH-)是由水电离产生的,即水电离产生的c(OH-)=1.0×109molL1;
,酸溶液中c(OH-)是由水电离产生的,即水电离产生的c(OH-)=1.0×109molL1;
④pH=5的NaHSO4 溶液,c(H+)=1.0×105molL1;![]() ,盐溶液电离显酸性,因此溶液中c(OH-)是由水电离产生的,即水电离产生的c(OH-)=1.0×109molL1;
,盐溶液电离显酸性,因此溶液中c(OH-)是由水电离产生的,即水电离产生的c(OH-)=1.0×109molL1;
因此溶液中由水电离产生的c(OH-)相同的是①③④,答案为D。


科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。如图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )

A.该装置将化学能最终只转化为电能
B.b处为电池正极,发生还原反应
C.a处通入O2
D.通入O2的电极上发生的电极反应为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___,3d能级上的未成对电子数为___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点___(填“高于”或“低于”)膦(PH3),原因是___。
(3)单质铜及镍都是由___键形成的晶体;元素铜与镍的第二电离能分别为ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(4)某镍白铜合金的立方晶胞结构如图所示。
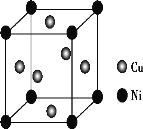
①晶胞中铜原子与镍原子的数量比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烷烃和气态单烯烃组成的混合气体,其密度是同条件下H2密度的13倍,把标准状况下2.24 L,该混合体通入足量的溴水中,溴水增重1.4 g。
(1)该混合烃的平均摩尔质量为________;其中一定含有________(写名称)。
(2)通过简计算,确定另一种烃的分子组成:_________。
(3)写出该混合烃中单烯烃所有可能的异构体(考虑顺反异构)任意写两种________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.C(s) +O2(g) = CO2(g) ΔH=+110.5 kJ·mol1
B.CH4(g) +2O2(g) = CO2(g)+2H2O(l) ΔH=-890.31 kJ·mol1
C.H2(g) +![]() O2(g)= H2O(g) ΔH=-241.8 kJ·mol1
O2(g)= H2O(g) ΔH=-241.8 kJ·mol1
D.2C8H18(l) +25O2(g) = 16CO2(g)+18H2O(l) ΔH=-11036 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
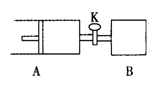
A.反应速率:v(B)<v(A)
B.平衡时Y的体积分数:A>B
C.打开K后达平衡时A的体积为2.4a L
D.A容器中X的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是___。
a.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是___![]() 向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有___和___。
向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有___和___。
(3)PCl3分子中,Cl-P-Cl键的键角___109°28'(填“>”“<”或“2”![]() 。
。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。已知该晶体的密度为ρg·cm-3,晶胞的边长为acm,则阿伏加德罗常数为___mol-1(用含p、a的式子表示![]() 。
。
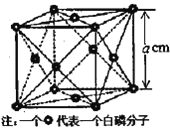
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、T均为短周期元素,X、Y、T原子最外层电子数之和为18。下列说法正确的是
![]()
A.X、Y、T三种元素最低价氢化物的沸点依次升高
B.X、Y和氢三种元素可共同形成离子化合物或共价化合物
C.物质WY2、ZY2一定都有熔点高、硬度大的特性
D.元素X、Y、T的最高正价的顺序为:T>Y>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com