
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将0.1mol•L-1 Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1 Na2SO4溶液,无明显现象 | 证明Ksp(BaSO4)> Ksp(BaCO3) |
| B | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀 | 证明KI3溶液中存在I3-?I2+I-平衡 |
| C | 向NaAlO2溶液中持续通入气体Y,先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
| D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.表达式相同的溶度积,溶度积常数大的物质能转化为溶度积常数小的物质;
B.向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,说明溶液中含有碘,后者有黄色沉淀,说明溶液中含有碘离子;
C.氢氧化铝能溶于强酸但不溶于弱酸;
D.酸性条件下,硝酸根离子能氧化亚铁离子生成铁离子,双氧水能氧化亚铁离子生成铁离子.
解答 解:A.表达式相同的溶度积,溶度积常数大的物质能转化为溶度积常数小的物质,硫酸钡、碳酸钡都是白色沉淀,所以没有明显现象,且Ksp(BaSO4)<Ksp(BaCO3),故A错误;
B.向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,说明溶液中含有碘,后者有黄色沉淀,说明溶液中含有碘离子,原来的溶液是KI3溶液,由现象可知,KI3溶液中存在I3-?I2+I-平衡,故B正确;
C.氢氧化铝只能溶解在强酸中,若Y是CO2气体,观察到出现白色沉淀,且沉淀不溶解,故C错误;
D.酸性溶液中硝酸盐具有强氧化性,则溶液变黄色,可能为亚铁离子被硝酸根离子氧化,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化性强弱比较、化学平衡、溶度积大小比较、氢氧化铝的性质等知识点,明确实验原理、物质性质是解本题关键,注意D中隐含条件的挖掘,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化 | |
| D. | 金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
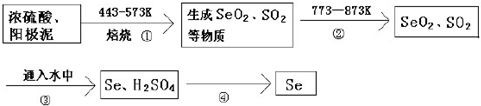
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
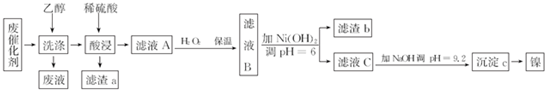
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响 b.实验1和3探究反应物浓度对该反应速率的影响. c.实验2和4探究催化剂对反应速率的影响 | |
| 体积(mL) | 浓度(mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |

| 试验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用热的纯碱水洗手时更容易除去手上的油脂污垢 | |
| B. | 若发现厨房内天然气发生了泄漏,应立即打开门窗 | |
| C. | 用无水硫酸铜检验酒精中含有水的过程中发生了化学变化 | |
| D. | 抗战胜利70周年阅兵式上释放的气球中充入的是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com