
请分析在潮湿的空气中钢铁被腐蚀的原因。
_________________________________________________________________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
第题(分)化学世界里有许多“另类”的物质。如亚铁盐在空气中通常不稳定,易被氧化,如FeSO4·7H2O。而(NH4) 2Fe(SO4)2·6H2O晶体比FeSO4·7H2O晶体等其它亚铁盐稳定许多,可在分析化学中做基准试剂。常温下FeSO4·7H2O在空气中容易失去结晶水成为FeSO4,而(NH4) 2Fe(SO4)2.·6H2O失去结晶水困难许多。
FeSO4·7H2O的晶胞参数为a=1.407nm,b=0.6503nm,c=1.104nm, α=γ=90.00°, β=105.57°密度为1.898g/cm3,无水FeSO4晶体中最近的Fe—O距离为0.212nm,S—O距离为0.151nm,Fe—S距离为0.475nm,Fe—Fe距离为0.769nm,(NH4) 2Fe(SO4)2·6H2O的晶胞参数为a=0.932nm,b=1.265nm,c=0.624nm,α=γ=90.00°,β=106.80°,密度为1.864g/cm3,最近的Fe—O距离0.209nm,S—O距离为0.149nm,Fe—Fe距离为0.486nm,NH4+—Fe距离为0.483nm,N—S距离为0.361nm
⑴ 计算一个FeSO4·7H2O晶胞和一个(NH4) 2Fe(SO4)2·6H2O晶胞分别所含原子个数
⑵ 晶体自身的结构如空隙大小直接影响化学反应进行的趋势,试通过计算说明
FeSO4·7H2O比(NH4) 2Fe(SO4)2.·6H2O更易被氧化
已知:O的共价半径为0.66nm,在晶体中+2价的Fe半径为0.061nm,—2价的O半径为0.121nm,+6价的S半径为0.029nm,—3价的N半径为0.148nm
⑶ FeSO4·7H2O在潮湿的空气中被氧化的产物为Fe(OH)SO4·3H2O,写出反应的化学方程式
_____________________________________________________________
⑷ 在水溶液中(NH4) 2Fe(SO4)2·6H2O与FeSO4·7H2O稳定性相当,请分析其原因
查看答案和解析>>
科目:高中化学 来源:广东省模拟题 题型:填空题
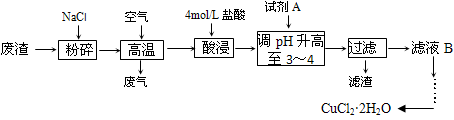
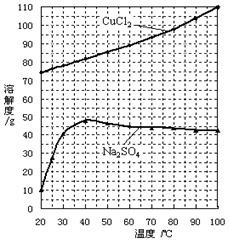
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com