
| A. | 向2.0mL浓度均为0.lmol•L-l的KC1、KI混合溶液中滴加1~2滴0.0lmol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比Agl的Ksp大 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2,铜粉仍不溶解 | |
| C. | 向AIC13溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失 | |
| D. | 将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2,也无沉淀产生 |
分析 A.溶度积小的先沉淀;
B.Cu与过氧化氢在酸性条件下发生氧化还原反应;
C.NaHSO4溶液电离出氢离子,可溶解氢氧化铝;
D.Ba(NO3)2溶液与SO2发生氧化还原反应生成硫酸钡沉淀.
解答 解:A.沉淀呈黄色,可知先生成AgI沉淀,则说明AgCl的Ksp比Agl的Ksp大,故A正确;
B.Cu与过氧化氢在酸性条件下发生氧化还原反应,则再加入适量的H2O2,铜粉溶解,故B错误;
C.NaHSO4溶液电离出氢离子,可溶解氢氧化铝,则再加入NaHSO4溶液,沉淀消失,故C错误;
D.Ba(NO3)2溶液与SO2发生氧化还原反应生成硫酸钡沉淀,则CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生,再通入SO2,有沉淀产生,故D错误;
故选A.
点评 本题考查难溶电解质的生成及氧化还原反应,为高频考点,把握Ksp的比较、氧化还原反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
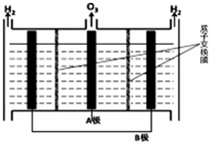 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与3 mol H2反应生成的NH3分子数为2NA | |
| B. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| C. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备氨气 | 将浓氨水逐滴滴入CaO固体中 |
| B | 制备氯气 | 将浓盐酸逐滴滴入浓硫酸 |
| C | 制备氧气 | 向双氧水中滴入ZnSO4溶液 |
| D | 制备氢气 | 酒精灯加热碳与水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Al3+ | C. | NH4+ | D. | Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| B. | 含有大量Fe2+的溶液中:K+、Mg2+、C1O-、SO42- | |
| C. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=l×10-12mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 气体的总物质的量 | |
| D. | 单位时间内生成nmolC的同时消耗2nmolB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4g | |
| D. | 减压过滤的原理是抽气泵给吸滤瓶减压,造成吸滤瓶内与布氏漏斗液面上的压力差,从而加快过滤速度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com