


科目:高中化学 来源: 题型:
A、NaHCO3溶液加水稀释,
| ||
| B、1 mol?L-1的NH4Cl溶液中含有NH4+的数目一定小于NA | ||
| C、用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-═2Fe(OH)3↓+3H2↑ | ||
| D、将带有相反电荷的胶体混合,一定会出现胶体聚沉现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、维持温度和体积不变,使A和C的量加倍 |
| B、维持温度和体积不变,使B和C的量加倍 |
| C、维持温度和压强不变,使A.B.C的量均加倍 |
| D、维持温度和压强不变,使A.B.C的量均减半 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水的反应:Na+H2O═Na++OH-+H2↑ |
| B、溴化亚铁溶液中滴加少量氯水:2 Br-+Cl2═Br2+2Cl- |
| C、碳酸氢钙溶液加入过量的氢氧化钙溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| D、等体积同浓度NaHSO4、Ba(OH)2两溶液混合H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
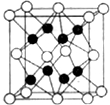 已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,A在所有元素中原子半径最小,B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题:
已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,A在所有元素中原子半径最小,B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
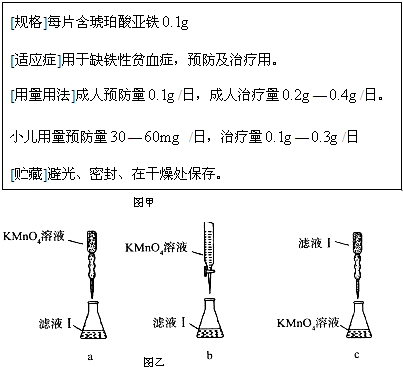
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com