
【题目】下列实验可以达到目的或得出结论的是( )
选项 | 实验目的或结论 | 实验过程 |
A | 探究浓硫酸的脱水性 | 向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 相同温度下,Ksp(ZnS)<Ksp(CuS) | 向2mL ZnSO4 和CuSO4的混合溶液中逐滴加入0.01mol/L Na2S溶液,先出现白色沉淀 |
C | 淀粉已经完全水解 | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 |
D |
| 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。
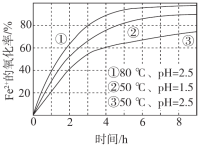
4Fe2+(aq)+4H+(aq)+O2(g)=4Fe3+(aq)+2H2O(l) ΔH>0
下列分析或推测合理的是
A.由①、②可知,pH越大,Fe2+越易被氧化
B.由②、③推测,若pH>7,Fe2+更难被氧化
C.pH=2.5、70℃时,0~3 h内Fe2+的平均消耗速率ν(Fe2+) < ![]() mol/(L·h)
mol/(L·h)
D.曲线②的变化趋势推测,反应吸热使得溶液温度下降,反应速率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
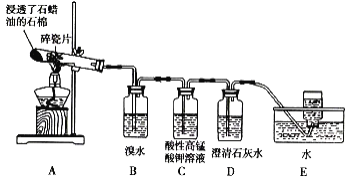
【题目】某同学设计实验探究工业制乙烯的原理和乙烯主要的化学性质,实验装置如图所示。
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热、加压条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷可发生如下反应,反应式已配平:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为______;乙的结构简式为____。
4乙,则甲的分子式为______;乙的结构简式为____。
(2)B装置中的实验现象是______。
(3)C装置中的实验现象是_____,其中发生反应的反应类型是___。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_(填序号)中的实验现象可判断该资料是否真实。
(5)通过题述实验探究可知,检验甲烷和乙烯的方法是_____(填序号,下同);除去甲烷中乙烯的方法是____。
A.气体通入水中 B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,乙烯产生黑烟,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯(![]() 可写成C6H5NO2)是一种剧毒化学品,具有致畸、致突变和致癌性。处理含有硝基苯废水的方法有很多,下图是铁、碳微电池法处理含硝基苯废水的工业流程图:
可写成C6H5NO2)是一种剧毒化学品,具有致畸、致突变和致癌性。处理含有硝基苯废水的方法有很多,下图是铁、碳微电池法处理含硝基苯废水的工业流程图:
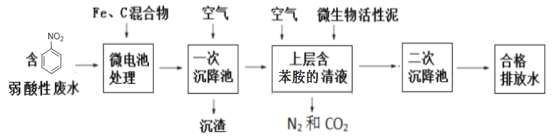
请回答下列问题:
(1)实验室制备硝基苯的化学方程式:_______________________________________;
(2)用分液漏斗分离硝基苯和水的混合物时,硝基苯从_______(填“上”或“下”)口流出。
(3)微电池处理过程中,原电池的负极反应为:Fe-2e-=Fe2+;
①碳表面硝基苯在电极上被还原成苯胺(![]() )的电极反应方程式为:_______________________;
)的电极反应方程式为:_______________________;
②微电池处理过程中部分硝基苯被新生成的活性Fe2+还原成苯胺,该反应的离子反应方程式为:__________________________________________________;
(4)①一次沉降池中通入空气的目的:_____________________________________;
②一次沉降池中适当的升温有利于沉渣的迅速沉降,分析原因:_______________________;(用适当的文字描述和离子方程式解释)
(5)上图中微生物在空气存在的条件下降解苯胺的化学反应方程式为:____________________________。
(6)利用惰性吸附电极电解含硝基苯的废水,同样可以将剧毒的硝基苯转化成苯胺,在电解的过程中,含硝基苯的废水应从_____________极室流入(填:“阳”或“阴”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粮食仓储常用磷化铝(A1P)熏蒸杀虫,A1P遇水即产生强还原性的PH3气体。国家标准规定粮食中磷化物(以PH3计)的残留量不超过0.05 mgkg-1时为合格。某小组同学用图所示实验装置和原理测定某粮食样品中磷化物的残留量。C中加入100 g原粮,E 中加入20.00mL2.50×l0-4molL-1KMnO4溶液(H2SO4酸化),C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中的溶液。
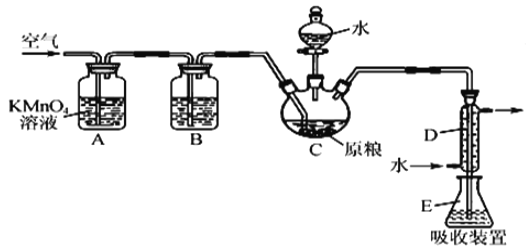
(1)装置A中的KMnO4溶液的作用是_____。
(2)装置B中盛装焦性没食子酸的碱性溶液吸收空气中的O2。若去掉该装置,则测得的磷化物的残留量______________________(填“偏髙”“偏低”或“不变”)。
(3)装置E中PH3氧化成磷酸,MnO4-被还原为Mn2+,写出该反应的离子方程式:___________
(4)收集装置E中的吸收液,加水稀释至250 mL,量取其中的25.00 mL于锥形瓶中, 用4.0×l0-5molL-1的Na2SO3标准溶液滴定,消耗Na2SO3标准溶液20.00mL,反应原理是 SO32-+MnO4-+H+→SO42-+Mn2++H20(未配平)通过计算判断该样品是否合格(写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,HCN溶液中CN-和HCN浓度所占分数(α)随pH变化的关系如图所示,下列表述正确的是( )
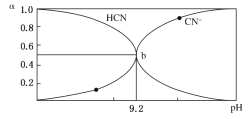
A.Ka(HCN)的数量级为10-9
B.0.1mol/LHCN溶液使甲基橙试液显红色
C.1L物质的量都是0.1mol的HCN和NaCN混合溶液中c(HCN)>c(CN-)
D.0.1mol/LNaCN溶液的pH=9.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]= 1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解常数为1.0×10-10。
B. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6mol·L-1
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2(s)+2HCOOH(aq)![]() Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com