
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )

A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为NiCl2+2e-===Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
酰胺(肽键)水解比醋水解困难
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
1.焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________mol/。
2.若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
3.硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。
4.用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列涉及有机物的说法正确的是( )
A.乙烯和聚乙烯都能发生加聚反应
B.汽油、煤油、柴油和植物油都是碳氢化合物
C.乙烯、苯都可与溴水发生加成反应
D.2己烯能使KMnO4(H+)溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氢氧燃料电池以KOH溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将________,溶液的pH____________________________________________________。
(填“减小”、“增大”或“不变”)
(2)氢氧燃料电池以H2SO4溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将________,溶液的pH_____________________________________________________。
(填“减小”、“增大”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图,下列判断中正确的是 ( )
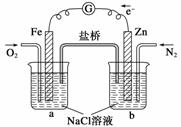
A.烧杯a中的溶液pH降低
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2
D.烧杯b中发生的反应为2Cl--2e-===Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本 结构如图所示,其中作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出 电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是 ( )

A.正极反应式:Ca+2Cl--2e-===CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇燃料电池中采用磺酸类质子溶剂,在一定温度下供电,电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意图如图。下列说法中错误的是 ( )
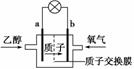
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a极上发生的电极反应是C2H5OH+3H2O+12e-===2CO2+12H+
D.b极上发生的电极反应是4H++O2+4e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com