
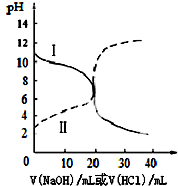
 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时溶液的pH=5则:c(H+)-c((NH3•H2O)=c(OH-)=1×10-9 mol•L-1 | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
分析 根据未加盐酸和氢氧化钠时图象纵坐标所对应pH值可知,曲线Ⅰ是盐酸滴定氨水,因为当未滴加溶液时,Ⅰ的pH>7;
曲线Ⅱ是氢氧化钠滴定醋酸滴定氨水,因为当未滴加溶液时,曲线Ⅱ的pH<7;
然后再根据溶液中的溶质离子的物料守恒、电荷守恒及溶液的酸碱性就可以解决问题.
解答 解:根据曲线变化趋势知,当未滴加溶液时,曲线I的pH>7,说明属于酸滴定碱溶液,根据曲线变化趋势知,当未滴加溶液时,曲线II的pH<7,说明属于碱滴定酸溶液,
A.曲线I为酸滴定碱溶液,当滴加溶液到20mL时,溶液中的溶质是氯化铵,溶液呈酸性,根据质子守恒可得:c(H+)=c((NH3•H2O)+c(OH-),则c(H+)-c((NH3•H2O)=c(OH-)=1×10-9 mol•L-1,故A正确;
B.曲线I为酸滴定碱溶液,当滴加溶液到20mL时,溶液中的溶质是氯化铵,溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以得c(Cl-)>c(NH4+),盐类水解程度较小,所以离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.曲线II为氢氧化钠滴定醋酸溶液的曲线,滴加溶液在10 mL~20 mL之间时,溶液中的溶质是醋酸钠和醋酸,醋酸电离程度大于醋酸根离子水解程度,则溶液中c(H+)>c(OH-),且不存在氯离子,故C错误;
D.滴加溶液到10 mL时,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),所以得c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断,涉及离子浓度大小比较、电解质溶液中盐的水解和弱电解质的电离平衡等知识,题目难度中等,注意掌握判断溶液中离子浓度大小方法,明确盐的水解原理、弱电解质的电离及其影响,注意电荷守恒、物料守恒、质子守恒的应用方法.


 阅读快车系列答案
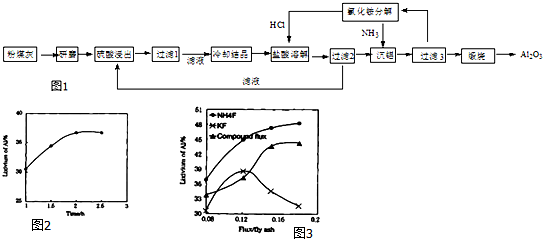
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与稀盐酸反应放出气体的快慢:Na2CO3>NaHCO3 | |
| B. | 配制成同物质的量浓度的溶液时,溶液的pH:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3 | |
| D. | 在Na2CO3和NaHCO3的稀溶液中,加CaCl2溶液都有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
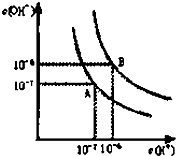 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
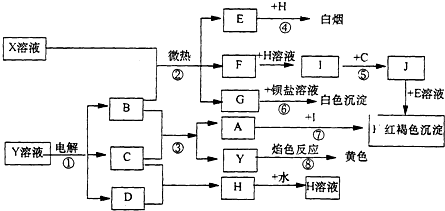
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
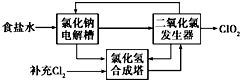 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
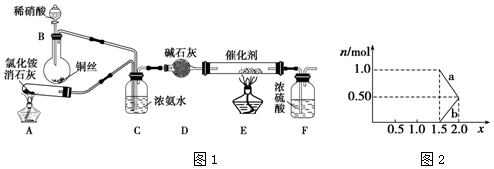
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
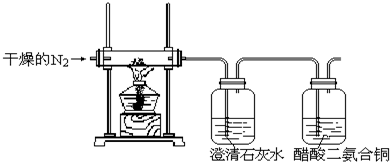
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com