
【题目】在2L密闭容器中进行反应![]() ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在![]() min内,各物质物质的量的变化如下表所示:
min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知2min内![]() ,
,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时![]() __________,
__________,![]() __________。
__________。
(2)方程式中m=__________,n=__________,p=__________,q=__________。
(3)用Z表示2min内的反应速率:____________________。
【答案】![]()
![]() 1 4 2 3
1 4 2 3 ![]()
【解析】
本题考查化学反应速率的计算,利用速率之比等于化学计量数之比求得。可以利用三段式找到起始量、转化量、2min末,分析已知数据得出该反应是从右向左进行。
对比![]() 的起始量和2
的起始量和2![]() 末的量,可知反应逆向进行。
末的量,可知反应逆向进行。
![]() 。
。
对反应过程作三段式法分析如下:
mX(g) +nY(g)![]() pZ(g) +qQ(g)
pZ(g) +qQ(g)
始/mol 0.7 n(Y) 1 n(Q)
变/mol △n(X) △n(Y) △n(Z) 0.3
2min末/mol 0.8 2.7 0.8 2.7
故![]()
![]()
![]()
因![]() ,
, ,
,
所以![]() ,
,
![]() 。
。
故答案为(1).n(Y)=2.3mol, n(Q)=3 mol
(2)方程式中化学计量数之比等于各物质的物质的量浓度的变化量之比,
m:n:p:q = △n(X):△n(Y):△n(Z):△n(Q)=0.1 mol:0.4 mol:0.2 mol:0.3 mol=1:4:2:3,故答案为1,4,2,3;
(3)已知2min内![]() ,υ(Z):υ(Q)=2:3,知υ(Z)=
,υ(Z):υ(Q)=2:3,知υ(Z)=![]() ,故答案为
,故答案为![]() 。
。


科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)如图是1mol NO2(g)和 1mol CO(g)反应生成 1mol CO2(g)和 1mol NO(g)过程中能量变化示意图。

①该反应是_________(填“吸热”或 “放热”)反应。
②请写出反应的热化学方程式_________。
③若在该反应体系中加入催化剂对反应热_________(填“有”或“没有”)影 响。原因是_________。
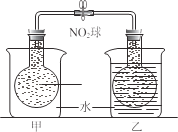
(2)已知,可逆反应2NO2 (g)N2O4 (g) ΔH=56.9 kJ/mol。在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色变深。根据现象,补全CaO与H2O反应过程的能量变化示意图_________。
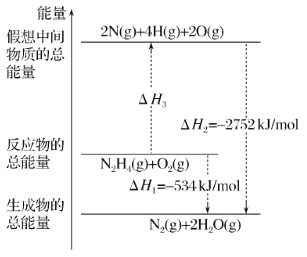
(3)肼(N2H4)是一种应用广泛的化工原料,可作为火箭发动机的燃料。已知断裂 1 mol 化学键所需的能量:N≡N 为 942 kJ、O=O 为 500 kJ、N-N 为154 kJ,则断裂 1 mol N-H 键所需的能量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据央广新闻报道,2016年我国河南桐柏县发现特大金矿,含金量近105吨可挖80年。除了发现的特大金矿,同时还发现大量天然碱、铅锌矿产资源。根据上述信息,回答下列问题:
(1)铅原子的价层电子排布式为__________,原子核外有__________个未成对电子。
(2)锌与镓(Ga)同周期,锌的第一电离能大于镓的第一电离能,其原因是________________。
(3)天然碱的化学式为Na2CO3·NaHCO3·2H2O。
(I)天然碱的晶体类型是__________;H2O的VSEPR模型为______________。
(Ⅱ)Na2CO3中存在的作用力类型主要有__________,CO32-中C的杂化类型为___________。
(4)金是贵重金属。冶金工业上,提取金的原理是2[Au(CN)2]一+Zn=2Au+[Zn(CN)4]2-。与CN一互为等电子体的离子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
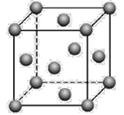
(5)金晶体的晶胞结构如图所示。已知金的密度为ρ g·cm3,摩尔质量M(Au)=197g·mol-1,阿伏加德罗常数为NA。则晶体中金原子的配位数为_______,金原子(或粒子)的半径r=___pm(用含ρ和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为____________,若将负极材料改为CH4,写出其负极反应方程式______________。
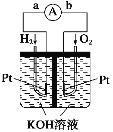
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是PH3,其结构式为___________,下列有关PH3的说法错误的是___________。
a.PH3分子是极性分子
b.PH3分子稳定性低于NH3分子,因为N-H键键能高
c.一个PH3分子中,P原子核外有一对孤电子对
d.PH3沸点低于NH3沸点,因为P-H键键能低
(2)“荧光”产生的原理是Ca3P2在潮湿的空气中剧烈反应,写出该反应的化学方程式____________________。
(3)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H | 白磷分子结构 |
键能/(kJ·mol-1) | 213 | 436 | 322 |
|
则反应4PH3(g)![]() P4(g)+6H2(g) △H=___________ kJ· mol-1。
P4(g)+6H2(g) △H=___________ kJ· mol-1。
(4)某温度下,向容积为2L的密闭容器中通入2 mol PH3发生(3)中反应,5min后反应达平衡,测得此时H2的物质的量为1.5 mol,则用PH3表示的这段时间内的化学反应速率v(PH3)=__________;下列说法能表明该反应达到平衡状态的是___________。
A.混合气体的密度不变 B.6v(PH3)=4v(H2)
C.c(PH3):c(P4):c(H2)=4:1:6 D.混合气体的压强不变
(5)PH3有毒,白磷工厂常用Cu2+、Pd2+液相脱除PH3:PH3+2O2![]() H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:
H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:

(I)由图可知,富氧有利于____________(选填“延长”或“缩短”)催化作用的持续时间。
(Ⅱ)随着反应进行,PH3的净化效率急剧降低的原因可能为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)海水中有丰富的食盐资源,工业上以粗食盐水(含少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。流程如下:

请回答:
①粗盐精制过程中加入的沉淀剂是石灰乳和纯碱,加入顺序是_____。
②上述流程中循环使用的物质是____。
③上图中制得的饱和食盐水还可用于氯碱工业,NaCl 溶液的电解产物可用于生产盐酸、漂白粉、氢氧化钠等产品。工业上电解饱和食盐水的离子方程式为_____。
④氨气可用电解法合成,其原料转化率大幅度提高, 有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图 1 和图 2 所示。

图 1 中,a 电极上通入的X 为_____。图 2 中,d 电极上的电极反应式为_________。
(2)海水中有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如图 3 所示:

图 3
①金属锂在电极_____(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是_____。
③某种锂离子二次电池的总反应为:FePO4(s)+Li(s)![]() LiFePO4(s) , 装置如下图所示(a 极材料为金属锂和石墨的复合材料)。下列说法不正确的是_____。
LiFePO4(s) , 装置如下图所示(a 极材料为金属锂和石墨的复合材料)。下列说法不正确的是_____。

A.图中 e-及 Li+移动方向说明该电池处于放电状态
B.该电池中a 极不能接触水溶液
C.充电时 a 极连接外接电源的正极
D.充电时,b 极电极反应式为:LiFePO4-e-= Li++ FePO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷的浓硫酸。但某兴趣小组的同学发现将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为此他们进行了如下探究实验。
[探究一]称取铁钉(碳素钢)6.0g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X,并收集到气体Y。
(1)(I)甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,可以选用___________。
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
(Ⅱ)乙同学将336 mL(标准状况)气体Y通入足量溴水中,发现溶液颜色变浅,试用化学方程式解释溴水颜色变浅的原因___________,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为___________。(结果保留一位小数)。
[探究二]甲乙两同学认为气体Y中除SO2外,还可能含有H2和CO2。为此设计如图实验装置(图中夹持仪器省略)进行验证。

(2)简述该实验能产生少量H2的原因___________(用化学用语结合少量文字表述)。
(3)装置B中试剂的作用是___________,装置F的作用是___________。
(4)为了进一步确认CO2的存在,需在上述装置中添加M于___________(选填序号),M中所盛装的试剂可以是___________。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗高血压及心绞痛,某合成路线如下:

回答下列问题:
(1)写出C中能在NaOH溶液里发生反应的官能团的名称______。
(2)A→B和C→D的反应类型分别是___________、____________,H的分子式为______。
(3)反应E→F的化学方程式为______。
(4)试剂X的分子式为C3H5OCl,则X的结构简式为______。
(5)B的同分异构体中,写出符合以下条件:①含有苯环;②能发生银镜反应;③苯环上只有一个取代基且能发生水解反应的有机物的结构简式____________。
(6)4-苄基苯酚(![]() )是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:____________(无机试剂任用)。
)是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:____________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n![]() 氨水滴入10mL
氨水滴入10mL![]() 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是![]()
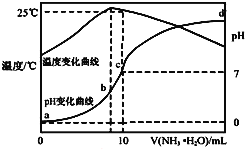
A.a点![]()
B.水的电离程度:![]()
C.b点:![]()
D.![]() 时
时![]() 水解常数为
水解常数为![]()
![]() 用n表示
用n表示![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com