
| n(碱)-n(酸) |
| V(碱)+V(酸) |
| n(碱)-n(酸) |
| V(碱)+V(酸) |
| 0.01mol/L×0.01L-0.01mol/L×VL |
| 0.01L+VL |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
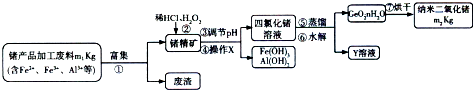
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3Cl不存在同分异构现象 |
| B、CH2Cl2不存在同分异构现象 |
| C、CHCl3不存在同分异构现象 |
| D、CH4是气体分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
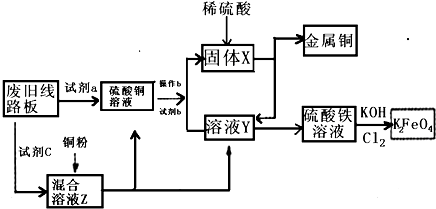 根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、日本福岛核电站泄露的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| B、“光化学烟雾”、“硝酸酸雨”的形成都与氮氧化合物有关 |
| C、汽油中添加Pb(C2H5)4,提高汽油的抗爆震性能,有利于改善大气环境 |
| D、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com