
分析 反应生成Cl2在标准状况下体积为56L,根据n=$\frac{V}{{V}_{m}}$计算物质的量,再根据方程式计算HCl,结合元素化合价的变化分析.
解答 解:(1)反应生成Cl2在标准状况下体积为56L,则氯气的物质的量为n=$\frac{V}{{V}_{m}}$=$\frac{56L}{22.4L/mol}$=2.5mol,则参加反应的HCl的物质的量为2.5mol×$\frac{16}{5}$=8mol;
答:参加反应的HCl的物质的量为8mol;
(2)反应中16molHCl只有8mol被氧化,即被氧化的HCl占总的HCl物质的量$\frac{1}{2}$,所以反应中被氧化的HCl的物质的量为4mol;
答:反应中被氧化的HCl的物质的量为4mol;
(3)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-,双线桥标出电子的转移方向和数目为 ,
,
答:并用双线桥标出电子转移的方向和数目 .
.
点评 本题考查物质的量的计算、化学方程式计算、氧化还原反应,题目难度不大,注意对基础知识的理解掌握,明确元素化合价的变化以及反应中各物质之间的关系是解题的关键.


科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 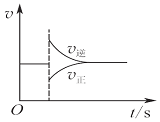 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 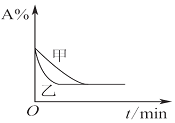 图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,且甲的压强大 | |
| C. | 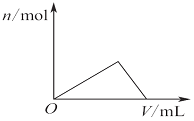 图表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 | |
| D. | 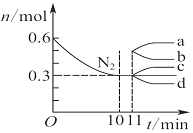 图表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol•L-1•min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在的电离平衡为:HCO3-+H2O?H2CO3+OH- | |
| B. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | HCO3-的电离程度大于HCO3-的水解程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com