
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,说明溶液中含有K+ | |
| B. | 向某无色溶液中滴加BaCl2溶液有白色沉淀出现,说明该溶液中一定含有SO42- | |
| C. | 向某溶液中加AgNO3溶液和稀盐酸,有白色沉淀出现,说明该溶液中一定含有Cl- | |
| D. | 向某溶液中加NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明该溶液中一定含有NH4+ |
分析 A.钠的焰色反应为黄色;
B.白色沉淀可能为AgCl;
C.检验氯离子,应先加硝酸,再加硝酸银;
D.产生能使湿润的红色石蕊试纸变蓝的气体,气体为氨气.
解答 解:A.钠的焰色反应为黄色,则用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,说明溶液中含有Na+,故A错误;
B.白色沉淀可能为AgCl,则不能确定是否含SO42-、Cl-,故B错误;
C.检验氯离子,应先加硝酸,再加硝酸银,且加盐酸引入Cl-,不能检验是否含Cl-,故C错误;
D.产生能使湿润的红色石蕊试纸变蓝的气体,气体为氨气,则该溶液中一定含有NH4+,故D正确;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握常见离子的检验方法、试剂与现象等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
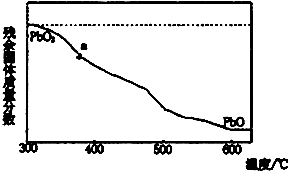 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石 | B. | 石墨 | C. | 铜 | D. | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
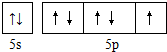 .
.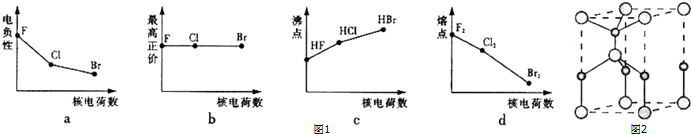
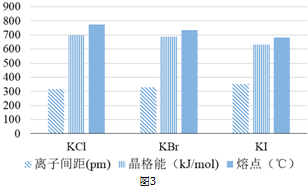
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂 | |
| B. | 硅可制作半导体材料 | |
| C. | 氢氧化钠常用于中和胃酸 | |
| D. | 常温下,铁制容器可用于盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
己知:60℃ 时,KNO3的溶解度为110g。在此温度下,向盛有l00mL水的烧杯中投入101g KNO3后充分搅拌,此烧杯中将会得到
A.悬浊液 B.饱和溶液
C.质量分数约为50%的溶液 D.物质的量浓度为10mol/L的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )| A. | 若甲为Na,则戊可能是H2O | B. | 若甲为C2H4,则戊可能是O2 | ||
| C. | 若甲为NO,则戊可能是H2O | D. | 若甲为Cl2,则戊可能是NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 前者大于后者 | C. | 后者大于前者 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com