
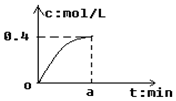
 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 5 | B. | 2.5 | C. | 7.5 | D. | 10 |
分析 根据化学反应速率与化学计量数成正比计算出在时间0-a min内用SO3表示的平均反应速率,然后根据v=$\frac{△c}{△t}$计算.
解答 解:反应速率与计量数成正比,则反应2SO2+O2?2SO3中,v(SO3)=2v(O2)=0.08mol/(L•min),
根据图象可知,amin时三氧化硫的物质的量浓度为0.4mol/L,则v(SO3)=$\frac{0.4mol/L}{amin}$=0.08mol/(L•min),解得:a=5,
故选A.
点评 本题考查了化学反应速率与化学计量数的关系,题目难度不大,明确化学反应速率与化学计量数成正比为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学计算能力.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
外围电子排布为3s23p5的元素在周期表中的位置是
A. 第三周期ⅦA族p区 B. 第三周期ⅦB族p区
C. 第三周期ⅦA族s区 D. 第四周期ⅢB族s区
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
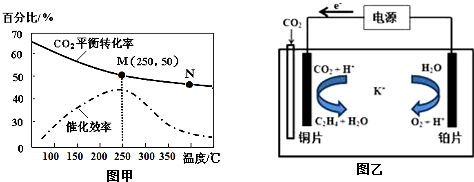
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):加一些水、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
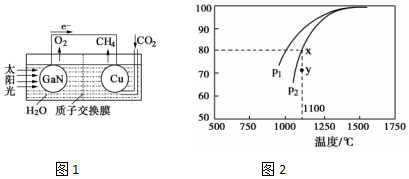 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有Cl- | |
| B. | 加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO42- | |
| C. | 向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl- | |
| D. | 已知丙酮是无色液体,不溶于水,密度小于水,分离水和丙酮的最合理方法为蒸馏或蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应大多数是放热反应,分解反应全都是吸热反应 | |
| B. | C(金刚石,s)+O2(g)=CO2(g)的反应热等于1molO2的键能与1molCO2中键能的差 | |
| C. | 热化学方程式中,反应条件可以不写,而且各物质前的化学计量数可以是分数 | |
| D. | 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 在3S+6KOH=2K2S+K2SO3+3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com