
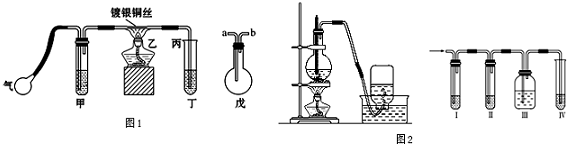
分析 (1)①乙醇易挥发,温度越高越易挥发,升高温度能促进乙醇的挥发;
②该反应引发后,不需加热即可进行,说明反应是放热的;乙醇催化氧化可以生成乙醛;
③为防止倒吸可以在乙、丙之间接上戊装置,起到安全瓶的作用,安全瓶中的导气管是“短进长出;
(2)①乙醇在浓硫酸的作用下反应得到乙烯;
②温度过高混有杂质气体二氧化硫,由装置可知,I中检验二氧化硫用品红溶液,II中NaOH除去二氧化硫,Ⅲ中品红检验二氧化硫除尽,Ⅳ中用酸性高锰酸钾溶液验证乙烯的还原性.
解答 解:(1)①乙醇具有挥发性,升高温度能促进乙醇的挥发,使生成乙醇蒸气的速率加快,
故答案为:使生成乙醇蒸气的速率加快;
②实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化生成乙醛和水,方程式为 2CH3CH2OH+O2$→_{加热}^{镀银铜丝}$2CH3CHO+H2O,故答案为:放热; 2CH3CH2OH+O2$→_{加热}^{镀银铜丝}$2CH3CHO+H2O;
③为防止防止丁中水倒吸,安全瓶中的导气管是“短进长出”,所以乙接b,a接,
故答案为:b;a;
(2)①实验室制取乙烯的化学方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
②由实验目的可知,确认上述混合气体中有乙烯和二氧化硫,I中试剂为品红溶液,II中试剂为NaOH溶液,Ⅲ中试剂为品红溶液,Ⅳ中试剂为酸性高锰酸钾溶液,能说明二氧硫存在的现象是装置I中品红溶液褪色,使用装置Ⅱ的目的是除去二氧化硫以免干扰乙烯的检验,使用装置Ⅲ的目的是检验二氧化硫是否除尽,验证乙烯还原性的现象为装置Ⅲ中品红不褪色,装置Ⅳ中酸性高锰酸钾溶液褪色,
故答案为:装置I中品红溶液褪色,装置Ⅲ中品红不褪色,装置Ⅳ中酸性高锰酸钾溶液褪色.
点评 本题考查了乙醇的催化氧化实验以及消去反应,把握物质的性质、检验及实验装置的作用为解答的关键,注意安全瓶连接方法、检验乙烯应排除二氧化硫的干扰,题目难度不大.


科目:高中化学 来源: 题型:多选题
 在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )
在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:饱和食盐水和HCl | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硫酸反应 | B. | 乙醇与HBr溶液共热制溴乙烷 | ||
| C. | 乙醇和浓硫酸共热至170℃ | D. | 油脂与强碱水溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 可用乙醇萃取溴水中的溴 | |
| D. | 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com