
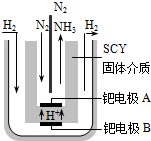
 合成氨工业及硝酸工业对工、农生产和国防都有重要意义.请回答:
合成氨工业及硝酸工业对工、农生产和国防都有重要意义.请回答:分析 (1)①化学平衡移动原理是指温度、浓度、压强等因素对化学平衡的移动造成的影响;
②a.根据三行式来求参加反应的氮气的物质的量,然后根据反应热得反应放热;
b.根据公式v=$\frac{△c}{△t}$进行计算求解;
c.若容器压强恒定,相当在容器容积恒定的基础上增大压强;
(2)①NH3被氧气催化氧化生成NO的反应的化学方程式是4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
②根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,求解;
b.根据n=$\frac{m}{M}$计算NO2的物质的量,反应中只有NO2中N元素化合价发生变化,发生歧化反应,有生成NO3-,根据注意电子数计算生成NO3-的物质的量,再根据电子转移守恒计算N元素在还原产物中的化合价,判断还原产物,据此书写;
(3)钯电极A上获得电子与B电极产生的氢离子生成氨气,发生还原反应,为电解池的阴极.
解答 解:(1)①a.用铁作催化剂加快化学反应速率,催化剂不能使平衡移动,使用催化剂是为了加快化学反应速率,用勒夏特列原理无法解释,故错误;
b.采用较高压强(20Mpa-50MPa),合成氨是气体体积减小的反应,加压至20~50MPa,有利于化学平衡正向移动,有利于氨的合成,故正确;
c.将原料气中的少量CO等气体净化除去,平衡不移动,故正确;
d.将生成的氨液化并及时从体系中分离出来能用勒夏特列原理解释,故正确;
故选bd;
②a.根据压强之比等于物质的量之比,故反应后容器内混合气体总的物质的量=4mol×$\frac{7}{8}$=3.5mol,则:
N2+3H2=2NH3 物质的量减少△n
1 1+3-2=2
n(N2) 4mol-3.5mol=0.5mol
故n(N2)=0.5mol×$\frac{1}{2}$=0.25mol,
所以反应热为:0.25mol×92.4kJ•mol-1=23.1 kJ,故答案为:23.1;
b.根据公式v=$\frac{△c}{△t}$=$\frac{\frac{1mol}{4L}}{4min}$=0.0625 mol/(L•min),故答案为:0.0625 mol/(L•min);
c.若容器压强恒定,相当在容器容积恒定的基础上增大压强,增大压强平衡正向移动,氮气的转化率增大,故答案为:>;
(2)①NH3被氧气催化氧化生成NO的反应的化学方程式是4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,故答案为:4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
②已知:2H2(g)+O2(g)=2H2O(g):△H=-483.6kJ/mol~~①
N2(g)+2O2(g)=2NO2(g):△H=+67.7kJ/mol~~②
由盖斯定律可知:将2①-②得:4H2(g)+2NO2(g)═N2(g)+4H2O(g);△H=-1034.9 kJ/mol,故答案为:4H2(g)+2NO2(g)═N2(g)+4H2O(g);△H=-1034.9 kJ/mol;
b.9.2gNO2的物质的量=$\frac{9.2}{46}$mol=0.2mol,反应中只有NO2中N元素化合价发生变化,发生歧化反应,有生成NO3-,
0.2mol二氧化氮转移电子的物质的量是0.1mol,故生成的NO3-的物质的量为$\frac{0.1mol}{5-4}$=0.1mol,故被还原的氮原子物质的量为0.2mol-0.1mol=0.1mol,令N元素在还原产物中的化合价为x价,则0.1mol×(4-x)=0.1mol,解得x=+3,故还原产物为NO2-,且生成的NO3-和NO2-物质的量之比为1:1,同时反应生成CO2,故二氧化氮和碳酸钠溶液反应的离子反应方程式为:2NO2+CO32-=NO3-+NO2-+CO2,故答案为:2NO2+CO32-=NO3-+NO2-+CO2;
(3)钯电极A上获得电子与B电极产生的氢离子生成氨气,发生还原反应,为电解池的阴极,阴极电极反应式为:N2+6e-+6H+═2NH3,
故答案为:阴; N2+6e-+6H+═2NH3.
点评 本题以合成氨为载体,考查化学平衡的移动原理及影响因素、反应速率计算热化学方程式、电解原理等,题目比较综合,侧重考查学生对知识的迁移应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水混合后振荡,水层褪色 | |
| B. | 乙烯通入酸性KMnO4溶液中,溶液褪色 | |
| C. | CH4与Cl2的混合气体光照后颜色变浅 | |
| D. | 乙烯通入溴水中,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
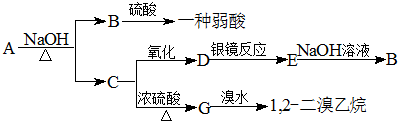
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
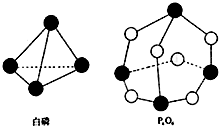 化学反应的本质是旧健的断裂和新键的形成过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198 P-O:360 O=O:498,则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学反应的本质是旧健的断裂和新键的形成过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198 P-O:360 O=O:498,则反应P4(白磷)+3O2→P4O6的能量变化为( )| A. | 吸收126kJ的能量 | B. | 释放126kJ的能量 | ||
| C. | 吸收1638kJ的能量 | D. | 释放1638kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 钠与Y只能形成Na2Y | |
| B. | Z形成的单质易溶于由X与Z形成的化合物 | |
| C. | Z得电子能力比W强 | |
| D. | X有多种同素异形体,而Y不存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
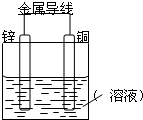 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | 灼热的炭与H2O反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com