
分析 (1)设H2和O2物质的量分别为amol、bmol,根据m=nM计算质量,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均相对分子质量;
设H2和O2质量分别为ag、bg,根据n=$\frac{m}{M}$计算物质的量,再根据M$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均相对分子质量;
(2)10mLA受热分解生成15mLO2和10mLF2,根据气体的体积之比等于物质的量之比,则方程式中A、O2、F2的物质的量之比是10:15:10=2:3:2,即该反应的化学方程式为2A=3O2+2F2,根据质量守恒定律得A的化学式.
解答 解:(1)设H2和O2物质的量分别为amol、bmol,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$可知平均相对分子质量为$\frac{2a+32b}{a+b}$;
设H2和O2质量分别为ag、bg,物质的量之比为$\frac{a}{2}$:$\frac{b}{32}$=16a:b,根据M$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$可知平均相对分子质量$\frac{16a×2+b×32}{16a+b}$=$\frac{32(a+b)}{16a+b}$,
故答案为:$\frac{2a+32b}{a+b}$;$\frac{32(a+b)}{16a+b}$;
(2)10mLA受热分解生成15mLO2和10mLF2,根据气体的体积之比等于物质的量之比,则方程式中A、O2、F2的物质的量之比是10:15:10=2:3:2,即该反应的化学方程式为2A=3O2+2F2,根据质量守恒定律得A的化学式为O3F2,推断的依据是阿伏伽德罗定律和质量守恒定律,
故答案为:O3F2;阿伏伽德罗定律和质量守恒定律.
点评 本题考查阿伏伽德罗定律、质量守恒定律的应用、物质的量有关计算,难度不大,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
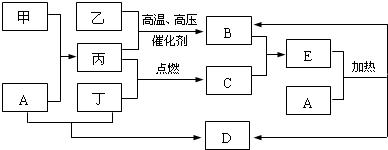
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
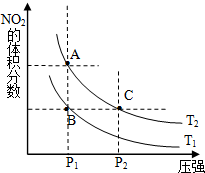 (1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).
(1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸电子式 | B. | 核内有8个中子的碳原子${\;}_{6}^{8}$C | ||
| C. | CO2的比例模型 | D. | 纯碱的化学式Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
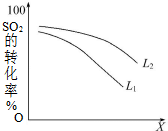 一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1
一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com