
| A. | HCI溶液的酸性比H2S溶液的酸性强 | |
| B. | 氯气能与硫化氢溶液反应:H2S+C12═2HCl+S↓ | |
| C. | 氯化氢比硫化氢稳定 | |
| D. | HClO4的酸性比H2SO4强 |
分析 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性、与氢气反应难易程度与剧烈程度、与变价金属反应中金属化合价、化合物中元素的化合价(对键合电子的吸引)等角度判断.
解答 解:A、不能根据氢化物的水溶液的酸性强弱比较非金属性,例如HI的酸性比HCl强,但非金属性Cl>I,硫化氢的酸性比盐酸弱,但非金属性Cl>S,故A错误;
B、氯气能与硫化氢溶液反应:H2S+C12═2HCl+S↓,此反应说明氯气的氧化性强于S单质,而单质的氧化性越强,对应元素的非金属性越强,故B正确;
C、氢化物越稳定,元素的非金属性越强,故HCl比H2S稳定,说明氯元素的非金属性比硫元素强,故C正确;
D、最高价含氧酸的酸性越强,非金属性越强,故高氯酸的酸性比硫酸强,说明氯的非金属性强于硫,故D正确.
故选A.
点评 本题把能用于判断元素非金属性强弱的因素与不能用于判断元素非金属性强弱的因素结合起来,具有很强的迷惑性,因此,牢固掌握、理解基本知识是解决这类题目的重中之重.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的乙酸又称为冰醋酸 | B. | 乙酸能与金属钠反应放出氢气 | ||
| C. | 乙酸的酸性比碳酸强 | D. | 乙酸与乙醇不互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 E的氢化物的分子式H2O.
E的氢化物的分子式H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢原子光谱是原子的所有光谱中最简单的光谱之一 | |
| B. | “量子化”就是不连续的意思,微观粒子运动均有此特点 | |
| C. | 玻尔理论不但成功地解释了氢原子光谱,而且还推广到其他原子光谱 | |
| D. | 原子中的电子在具有确定半径的圆周轨道上像火车一样高速运转着 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
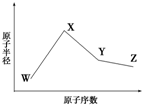 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量SO2通入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com