
【题目】16.8 g Fe 跟一定量浓 HNO3 反应,Fe 全部溶解,共收集 NO、NO2 的总体积为 11.2 L(标准状况),所得溶液中 H+的物质的量为 0.02 mol,请回答:
(1)反应中被还原的硝酸为_______________mol。
(2)反应过程中转移电子数为_______________。
(3)生成的 NO 与 NO2 的物质的量之比为__________________。
(4)反应后溶液中 NO3-的物质的量为___________mol。
(5)写出该反应的离子方程式:___________________________。
【答案】0.5 0.9NA 2:3 0.92 3Fe + 14H+ + 5NO3 - === 3Fe3+ + 2NO2↑ + 3NO ↑+7H2O
【解析】
由题意知浓硝酸的量“一定”,铁跟浓硝酸反应时HNO3被还原为NO2,当浓硝酸逐渐变稀后,HNO3被还原为NO。根据电子得失守恒和元素守恒进行相关计算。
(1)HNO3被还原的产物是NO和NO2气体,11.2LNO和NO2混合气体总物质的量=![]() =0.5mol,根据氮元素守恒可知,反应中被还原的硝酸物质的量为0.5mol。
=0.5mol,根据氮元素守恒可知,反应中被还原的硝酸物质的量为0.5mol。
(2)由题意知最后溶液中仍有H+,说明HNO3过量,16.8gFe全部溶解,说明反应中转移的电子数由16.8gFe决定。16.8gFe的物质的量=![]() =0.3mol,反应中每个Fe原子失去3个电子,所以0.3molFe失去电子的物质的量=0.3mol×3=0.9mol,即反应过程中转移电子数为0.9NA。
=0.3mol,反应中每个Fe原子失去3个电子,所以0.3molFe失去电子的物质的量=0.3mol×3=0.9mol,即反应过程中转移电子数为0.9NA。
(3)由反应中电子得失守恒可知,生成0.5molNO和NO2混合气体时HNO3共得到0.9mol电子,由化合价变化知HNO3~NO~得3e-,HNO3~NO2~得1e-,设混合气体中含有NO和NO2的物质的量分别为n(NO)、n(NO2),有方程式组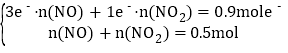 ,解得
,解得![]() ,因此,生成的NO与NO2的物质的量之比为0.2mol:0.3mol=2:3。
,因此,生成的NO与NO2的物质的量之比为0.2mol:0.3mol=2:3。
(4)反应得到的是HNO3和Fe(NO3)3混合溶液,其中HNO3的物质的量为0.02mol,Fe(NO3)3的物质的量为0.3mol,所以反应后溶液中NO3-的物质的量=0.02mol+0.3mol×3=0.92mol。
(5)根据上述分析可知,铁与硝酸反应生成Fe3+、NO、NO2和H2O,其中NO与NO2计量数之比为2:3,根据电子得失守恒、电荷守恒、质量守恒配平,该反应的离子方程式为:3Fe+14H++5NO3 -=3Fe3++2NO2↑+3NO↑+7H2O。


科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是( )
A. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
B. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡: NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价层电子排布式为________;高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:______________________________________________。
(2)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是___________________________。
(3)GaCl3和AsF3的立体构型分别是____________,____________。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
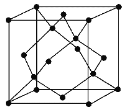
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 1cm3晶体的平均质量为______________(只要求列算式,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用水可以鉴别苯、四氯化碳、乙醇三种无色液体
B. 用Cu(OH)2悬浊液可以鉴别乙醇、乙酸溶液、葡萄糖溶液
C. 石油的分馏、煤的液化和气化都是物理变化,石油的裂化、裂解都是化学变化
D. 制取环氧乙烷:2CH2=CH2+O2Ag,250℃2![]() ,符合绿色化学的理念
,符合绿色化学的理念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g)+qD(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且m+n______p+q(填“>”、“<”或“=”)。
(2)若加入催化剂,平衡时气体混合物的总物质的量________(填“增大”、“减小”或“不变”)。
(3)若B是有色物质,A、C、D均为无色物质,则加入C(体积不变)时混合物的颜色__________(填“变深”、“变浅”或“不变”),而维持容器内气体的压强不变,充入氖气时,平衡__________移动(填“向左”、“向右”、或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示:
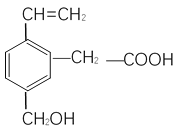
(1)此有机物中含官能团的名称_________________ (至少写两个)
(2)这种有机物不可能具有的性质是__________
A.能跟NaOH溶液反应 B.能使酸性KMnO4溶液褪色
C.1mol此有机物能与1molH2 加成 D.能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。

(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。

(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com