
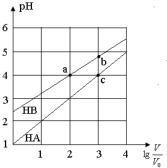
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c(B-)}{c(A-)}$减小 |
分析 0.1mol/L的HA溶液的pH=1,说明HA完全电离,所以HA为强酸,0.1mol/L的HB溶液的pH>2,说明HB在溶液中部分电离,所以HB是弱酸;
A.强酸强碱盐不水解,强碱弱酸盐水解显碱性;
B.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大;
C.a点时,存在平衡:HB?H++B-,稀释100倍后,HB溶液的pH=4,溶液中c(A-)≈c(OH-)=10-4mol/L,结合Ka=$\frac{c({H}^{+})c({B}^{-})}{c(HB)}$计算;
D.升高温度促进弱酸的电离,酸根离子浓度增大,强酸的酸根离子浓度不变.
解答 解:0.1mol/L的HA溶液的pH=1,说明HA完全电离,所以HA为强酸,0.1mol/L的HB溶液的pH>2,说明HB在溶液中部分电离,所以HB是弱酸;
A.HA为强酸,NaA是强酸强碱盐不水解,溶液显中性,NaB为强碱弱酸盐,水解显碱性,所以相同条件下NaA溶液的pH小于NaB溶液的pH,故A错误;
B.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大,氢离子浓度:a=c>b,所以溶液中水的电离程度:a=c<b,故B错误;
C.a点时,存在平衡:HB?H++B-,稀释100倍后,HB溶液的pH=4,溶液中c(A-)≈c(H+)=10-4mol/L,则Ka=$\frac{c({H}^{+})c({B}^{-})}{c(HB)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.001-1{0}^{-4}}$=1.11×10-5,故C正确;
D.升高温度促进弱酸的电离,所以HB中B-浓度增大,强酸的酸根离子浓度不变,所以A-的浓度不变,因此$\frac{c({B}^{-})}{c({A}^{-})}$增大,故D错误.
故选C.
点评 本题考查弱电解质电离与影响因素、电离平衡常数、pH有关计算等,为高考常见题型,侧重于学生的分析、计算能力的考查,关键是根据pH的变化判断强弱电解质,注意理解电离平衡常数计算过程中的估算问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、NO${\;}_{3}^{-}$、Na+ | B. | H+、Br-、CO${\;}_{3}^{2-}$、K+ | ||
| C. | Fe2+、K+、OH-、SO${\;}_{4}^{2-}$ | D. | H+、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
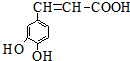
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3 mol CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com