
ŠæŗĶĀĮ¶¼ŹĒ»īĘĆ½šŹō£¬ĘäĒāŃõ»ÆĪļ¼ČÄÜČÜÓŚĒæĖį£¬ÓÖÄÜČÜÓŚĒæ¼ī£®µ«ŹĒĒāŃõ»ÆĀĮ²»ČÜÓŚ°±Ė®£¬¶ųĒāŃõ»ÆŠæÄÜČÜÓŚ°±Ė®£¬Éś³ÉZn£ØNH3£©42+£®»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©µ„ÖŹĀĮČÜÓŚĒāŃõ»ÆÄĘČÜŅŗŗó£¬ČÜŅŗÖŠĀĮŌŖĖŲµÄ“ęŌŚŠĪŹ½ĪŖ£ØÓĆ»ÆѧŹ½±ķŹ¾£©£®
£Ø2£©Š“³öŠæŗĶĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½£®
£Ø3£©ĻĀĮŠø÷×éÖŠµÄĮ½ÖÖČÜŅŗ£¬ÓĆĻą»„µĪ¼ÓµÄŹµŃé·½·Ø¼“æɼų±šµÄŹĒ£®
¢ŁĮņĖįĀĮŗĶĒāŃõ»ÆÄĘ ¢ŚĮņĖįĀĮŗĶ°±Ė®¢ŪĮņĖįŠæŗĶĒāŃõ»ÆÄĘ¢ÜĮņĖįŠæŗĶ°±Ė®
£Ø4£©Š“³öæÉČÜŠŌĀĮŃĪÓė°±Ė®·“Ó¦µÄĄė×Ó·½³ĢŹ½£®ŹŌ½āŹĶŌŚŹµŃéŹŅ²»ŹŹŅĖÓĆæÉČÜŠŌŠæŃĪÓė°±Ė®·“Ó¦ÖʱøĒāŃõ»ÆŠæµÄŌŅņ£®
| ĀĮµÄ»ÆѧŠŌÖŹ£»Ć¾”¢ĀĮµÄÖŲŅŖ»ÆŗĻĪļ£® | |
| ×ØĢā£ŗ | ¼øÖÖÖŲŅŖµÄ½šŹō¼°Ęä»ÆŗĻĪļ£® |
| ·ÖĪö£ŗ | £Ø1£©½šŹōĀĮŗĶĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĘ«ĀĮĖįÄĘŗĶĒāĘų£» £Ø2£©ŠæŗĶĒāŃõ»ÆÄʵķ“Ó¦Óė½šŹōĀĮŗĶĒāŃõ»ÆÄʵķ“Ó¦ĻąĖĘ£» £Ø3£©ÓĆĻą»„µĪ¼ÓµÄŹµŃé·½·ØŹ±£¬Čē¹ūĖł²śÉśµÄŹµŃé½į¹ū²»Ķ¬£¬¼“æɼų±š£» £Ø4£©æÉČÜŠŌĀĮŃĪÓė°±Ė®·“Ó¦æÉŅŌ»ńµĆĒāŃõ»ÆĀĮ³Įµķ£¬æÉČÜŠŌŠæŃĪÓė°±Ė®·“Ó¦»ńµĆĒāŃõ»ÆŠæ³ĮµķæÉŅŌČÜÓŚ¹żĮæµÄ°±Ė®ÖŠ£® |
| ½ā“š£ŗ | ½ā£ŗ£Ø1£©ŹōĀĮŗĶĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĘ«ĀĮĖįÄĘŗĶĒāĘų£¬ČÜŅŗÖŠĀĮŌŖĖŲµÄ“ęŌŚŠĪŹ½ĪŖNa[Al£Ø0H£©4]£¬¹Ź“š°øĪŖ£ŗNa[Al£ØOH£©4]£» £Ø2£©øł¾ŻĢāøÉŠÅĻ¢µĆŠæŗĶĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗZn+2NaOH+2H2O=Na2[Zn£Ø0H£©4]+H2”ü£¬¹Ź“š°øĪŖ£ŗZn+2NaOH+2H2O=Na2[Zn£Ø0H£©4]+H2”ü£» £Ø3£©¢ŁĮņĖįĀĮÖŠ¼ÓĒāŃõ»ÆÄĘ£¬ĻČ³öĻÖ³Įµķ£¬Č»ŗó³ĮµķĻūŹ§£¬Č»ŗóÓÖ³ö³Įµķ£¬ĻņĒāŃõ»ÆÄĘÖŠ¼ÓĮņĖįĀĮƻӊĻÖĻ󣬹ŹÓĆĻą»„µĪ¼ÓµÄŹµŃé·½·ØæÉŅŌ¼ų±š£» ¢ŚĮņĖįĀĮŗĶ°±Ė®²»¹ÜŹĒĖĶłĖÖŠĻą»„µĪ¼ÓŹĒĻÖĻó¾łŹĒ³öĻÖ°×É«³Įµķ£¬ÓĆĻą»„µĪ¼ÓµÄŹµŃé·½·Ø²»æÉŅŌ¼ų±š£» ¢ŪĶłĮņĖįŠæÖŠ¼ÓĒāŃõ»ÆÄĘŹ±£¬»į³öĻÖ°×É«³Įµķ£¬ĻņĒāŃõ»ÆÄĘÖŠ¼ÓĮņĖįŠæŹ±£¬ĪŽĻÖĻ󣬹ŹÓĆĻą»„µĪ¼ÓµÄŹµŃé·½·ØæÉŅŌ¼ų±š£» ¢ÜĶłĮņĖįŠæÖŠ¼Ó ¹Ź“š°øĪŖ£ŗ¢Ł¢Ū¢Ü£» £Ø4£©æÉČÜŠŌĀĮŃĪÓė°±Ė®·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗAl3++3NH3•H2O=Al£ØOH£©3”ż+3NH4+£¬ŌŚŹµŃéŹŅ²»ŹŹŅĖÓĆæÉČÜŠŌŠæŃĪÓė°±Ė®·“Ó¦ÖʱøĒāŃõ»ÆŠæ£¬ŅņĪŖæÉČÜŠŌŠæŃĪÓė°±Ė®·“Ó¦²śÉś µÄĒāŃõ»ÆŠææÉČÜÓŚ¹żĮæµÄ°±Ė®ÖŠ£¬Éś³ÉZn£ØNH3£©42+£¬°±Ė®µÄĮæ²»Ņ×æŲÖĘ£®¹Ź“š°øĪŖ£ŗAl3++3NH3•H2O=Al£ØOH£©3”ż+3NH4+£»æÉČÜŠŌŠæŃĪÓė°±Ė®·“Ó¦²śÉśµÄĒāŃõ»ÆŠææÉČÜÓŚ¹żĮæ µÄ°±Ė®ÖŠ£¬Éś³ÉZn£ØNH3£©42+£¬°±Ė®µÄĮæ²»Ņ×æŲÖĘ£® |
| µćĘĄ£ŗ | ±¾ĢāŹĒŅ»µĄŠÅĻ¢øų¶ØĢā£¬æ¼²éѧɜ·ÖĪöŗĶ½ā¾öĪŹĢāµÄÄÜĮ¦£¬ÄŃ¶Č½Ļ“ó£® |


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÓŠ¹Ų“߻ƼĮµÄ“߻ƻśĄķµČĪŹĢāæÉ“Ó”°ŅŅ“¼“ß»ÆŃõ»ÆŹµŃé”±µĆµ½Ņ»Š©ČĻŹ¶£¬Ę䏵Ńé×°ÖĆČēĻĀ£ŗ
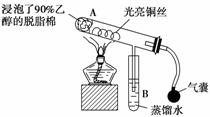
ŹµŃé²Ł×÷£ŗŌ¤ĻČŹ¹ĆŽ»ØĶŽžĶøŅŅ“¼£¬²¢°“ÕÕĶ¼°²×°ŗĆ£¬ŌŚĶĖæµÄÖŠ¼ä²æĪ»¼ÓČČ£¬Ę¬æĢŗóæŖŹ¼ÓŠ½Ś×ą(¼äŠŖŠŌ)µŲ¹ÄČėæÕĘų£¬¼“æɹŪ²ģµ½Ć÷ĻŌµÄŹµŃéĻÖĻó”£
Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ
(1)±»¼ÓČȵÄĶĖ擦·¢ÉśµÄ»Æѧ·½³ĢŹ½ĪŖ
________________________________________________________________________ӣ
(2)“ÓA¹ÜÖŠæɹŪ²ģµ½________________________________________µÄŹµŃéĻÖĻ󣬓ÓÖŠæÉČĻŹ¶µ½£¬ŌŚøĆŹµŃé¹ż³ĢÖŠ“߻ƼĮĘš“ß»Æ×÷ÓĆŹ±²Ī¼ÓĮĖ»Æѧ·“Ó¦£¬»¹æÉČĻŹ¶µ½“߻ƼĮĘš“ß»Æ×÷ÓĆŹ±ŠčŅŖŅ»¶ØµÄ____”£
(3)ŹµŃé½ųŠŠŅ»¶ĪŹ±¼äŗó£¬Čē¹ū³·µō¾Ę¾«µĘ£¬·“Ó¦»¹ÄÜ·ń¼ĢŠų½ųŠŠ£æŌŹÜČȵÄĶĖ擦ӊŹ²Ć“ĻÖĻó£æĪŖŹ²Ć“»įÓŠÕāÖÖĻÖĻó£æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚŅ»¶ØĢõ¼žĻĀ£¬ŗĻ³É°±·“Ó¦“ļµ½Ę½ŗāŗ󣬻ģŗĻĘųĢåÖŠNH3µÄĢå»ż·ÖŹżĪŖ25%”£Čō·“Ó¦Ē°ŗóŃ¹Ēæ²»±ä£¬Ōņ·“Ó¦ŗóĖõŠ”µÄĘųĢåĢå»żÓėŌ·“Ó¦ĪļĢå»żµÄ±ČÖµĪŖ(””””)””””””””””””””””””””””””””””””””
A£®1”Ć5 B£®1”Ć4 C£®1”Ć3 D£®1”Ć2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«Ņ»æéĆ¾ĀĮŗĻ½šČÜÓŚŃĪĖįŗó£¬ŌŁ¼ÓČė¹żĮæNaOHČÜŅŗ£¬ĖłµĆµÄČÜŅŗÖŠÖ÷ŅŖ“ęŌŚµÄĄė×ÓŹĒ£Ø£©
| A£® | AlO2©”¢OH©”¢Na+”¢Cl© | B£® | Na+”¢OH©”¢Al3+”¢Cl© | |
| C£® | AlO2©”¢OH©”¢Mg2+”¢Cl© | D£® | Na+”¢Mg2+”¢Al3+”¢Cl© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻņŅ»¶ØĮæµÄNaOHČÜŅŗÖŠÖšµĪ¼ÓČėAlCl3ČÜŅŗ£¬Éś³É³ĮµķAl£ØOH£©3µÄĮæĖęAlCl3¼ÓČėĮæµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ŌņĻĀĮŠĄė×Ó×éŌŚ¶ŌÓ¦µÄČÜŅŗÖŠŅ»¶ØÄÜ“óĮæ¹²“ęµÄŹĒ£Ø£©

| A£® | aµć¶ŌÓ¦µÄČÜŅŗÖŠ£ŗNa+”¢Fe3+”¢SO42©”¢HCO3© | |
| B£® | bµć¶ŌÓ¦µÄČÜŅŗÖŠ£ŗNa+”¢S2©”¢SO42©”¢Cl© | |
| C£® | cµć¶ŌÓ¦µÄČÜŅŗÖŠ£ŗAg+”¢Ca2+”¢NO3©”¢F© | |
| D£® | dµć¶ŌÓ¦µÄČÜŅŗÖŠ£ŗK+”¢NH4+”¢I©”¢CO32© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ· µÄŹĒ
µÄŹĒ
A£®ŅŅĻ©µÄÄź²śĮæĶس£ÓĆĄ“ŗāĮæŅ»øö¹ś¼ŅµÄŹÆÓĶ»Æ¹¤·¢Õ¹Ė®Ę½
B£®ĆŗµÄøÉĮóŹōÓŚĪļĄķ±ä»Æ
C£®ŹÆÓĶĮŃ»ÆµÄÖ÷ŅŖÄæµÄŹĒ³żČ„ŹÆÓĶÖŠµÄŌÓÖŹ
D£®Ń¹ĖõĢģČ»ĘųŗĶŅŗ»ÆŹÆÓĶĘųµÄÖ÷ŅŖ³É·Ö¾łĪŖŅ»Ńõ»ÆĢ¼
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖ2SO2+O2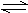 2SO3ŹĒŅ»øöÕż·“Ó¦·ÅČȵÄæÉÄę·“Ó¦”£Čē¹ū·“Ó¦ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ŌņĻĀĮŠÓŠ¹ŲĶ¾ŹöÕżČ·µÄŹĒ
2SO3ŹĒŅ»øöÕż·“Ó¦·ÅČȵÄæÉÄę·“Ó¦”£Čē¹ū·“Ó¦ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ŌņĻĀĮŠÓŠ¹ŲĶ¾ŹöÕżČ·µÄŹĒ
A£®Ź¹ÓĆ“ß»Æ¼ĮŹĒĪŖĮĖ¼Óæģ·“Ó¦ ĖŁĀŹ£¬ĢįøßÉś²śŠ§ĀŹ
ĖŁĀŹ£¬ĢįøßÉś²śŠ§ĀŹ
B£®ÉżøßĪĀ¶ČæɼÓæģÄę·“Ó¦ĖŁĀŹµ«²»ÄÜøıäÕż·“Ó¦ĖŁĀŹ
C£®Ņ»¶ØĢõ¼žĻĀ£¬SO2æÉ100%×Ŗ»ÆĪŖSO3
D£®ČĪŗĪĢõ¼žĻĀ£¬·“Ó¦“ļµ½Ę½ŗā£¬SO2µÄÅضČŅ»¶ØµČÓŚSO3µÄÅضČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”°¾ĘŹĒ³ĀµÄĻć”±£¬¾ĶŹĒŅņĪŖ¾ĘŌŚ“¢“ę¹ż³ĢÖŠÉś³ÉĮĖÓŠĻćĪ¶µÄŅŅĖįŅŅõ„£¬ŌŚŹµŃéŹŅĪŅĆĒŅ²æÉŅŌÓĆĻĀĶ¼ĖłŹ¾µÄ×°ÖĆĄ“ÖĘČ”ŅŅĖįŅŅõ„”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
 ””£Ø1£©Š“³öÓÉCH3COOHÓėC2H518OHÖĘČ”ŅŅĖįŅŅõ„µÄ»Æѧ·“Ó¦·½³ĢŹ½ £»øĆ·“Ó¦Źō£ß£ß£ß£ß·“Ó¦”£
””£Ø1£©Š“³öÓÉCH3COOHÓėC2H518OHÖĘČ”ŅŅĖįŅŅõ„µÄ»Æѧ·“Ó¦·½³ĢŹ½ £»øĆ·“Ó¦Źō£ß£ß£ß£ß·“Ó¦”£
””£Ø2£©øĆ·“Ó¦Šč¼ÓČėŅ»¶ØĮæµÄÅØĮņĖį£¬ŌņÅØĮņĖįµÄÖ÷ŅŖ×÷ÓĆŹĒ ”£
””£Ø3£©×°ÖĆÖŠĶØÕōĘųµÄµ¼¹ÜŅŖ²åŌŚ±„ŗĶĢ¼ĖįÄĘČÜŅŗµÄŅŗĆęÉĻ£¬²»ÄܲåČėČÜŅŗÖŠ£¬ÄæµÄŹĒ·ĄÖ¹”””””””””””””””””””£
””£Ø4£©ČōŅŖ°ŃÖʵƵÄŅŅĖįŅŅõ„·ÖĄė³öĄ“£¬Ó¦²ÉÓƵďµŃé²Ł×÷ŹĒ””””””””””””(Ģī²Ł×÷Ćū³Ę£©£»Ö÷ŅŖŹ¹ÓĆµÄ²£Į§ŅĒĘ÷ŹĒ ”££Ø“šŅĒĘ÷µÄĆū³Ę£©
””£Ø5£©Éś³ÉŅŅĖįŅŅõ„µÄ·“Ó¦ŹĒæÉÄę·“Ó¦£¬·“Ó¦Īļ²»ÄÜĶźČ«×Ŗ»Æ³ÉÉś³ÉĪļ£¬·“Ó¦Ņ»¶ĪŹ±¼äŗ󣬓ļµ½ĮĖ·“Ó¦µÄĻŽ¶Č£¬¼““ļµ½»ÆŃ§Ę½ŗāדĢ¬”£ĻĀĮŠĆčŹöÄÜĖµĆ÷ŅŅ“¼ÓėŅŅĖįµÄ·“Ó¦ŅŃ “ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄÓŠ(ĢīŠņŗÅ)”””””””””””””””””£
“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄÓŠ(ĢīŠņŗÅ)”””””””””””””””””£
””¢Łµ„Ī»Ź±¼äĄļ£¬Éś³É1molŅŅĖįŅŅõ„£¬Ķ¬Ź±Éś³É1molĖ®
””¢Śµ„Ī»Ź±¼äĄļ£¬Éś³É1molŅŅĖįŅŅõ„£¬Ķ¬Ź±Éś³É1molŅŅĖį
””¢Ūµ„Ī»Ź±¼äĄļ£¬ĻūŗÄ1molŅŅ“¼£¬Ķ¬Ź±ĻūŗÄ1molŅŅĖį
””¢ÜÕż·“Ó¦ĖŁĀŹÓėÄę·“Ó¦ĖŁĀŹĻąµČ
””¢Ż·“Ó¦»ģŗĻĪļÖŠø÷ĪļÖŹµÄÅØ¶Č²»ŌŁ ±ä»Æ
񄯒
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
æÉÄę·“Ó¦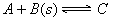 “ļµ½Ę½ŗāŗó£¬ĪŽĀŪ¼ÓŃ¹»ņ½µĪĀ”£BµÄ×Ŗ»ÆĀŹ¶¼Ōö“ó£¬ŌņĻĀĮŠ½įĀŪÕżČ·µÄŹĒĘųĢå
“ļµ½Ę½ŗāŗó£¬ĪŽĀŪ¼ÓŃ¹»ņ½µĪĀ”£BµÄ×Ŗ»ÆĀŹ¶¼Ōö“ó£¬ŌņĻĀĮŠ½įĀŪÕżČ·µÄŹĒĘųĢå
A. AĪŖ¹ĢĢ壬CĪŖĘųĢå£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦ B. AĪŖĘųĢ壬CĪŖ¹ĢĢå£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦
C. AĪŖĘųĢ壬CĪŖ¹ĢĢå£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦ D. A”¢C¾łĪŖĘųĢå£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com