
| A. | 2,2-二甲基-3-丁烷 | B. | 2,2-二甲基-2-丁烯 | ||
| C. | 2,2-二甲基-1-丁烯 | D. | 2,2-二甲基丁烷 |
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=2的1.0 L H2SO4溶液中含有H+的数目为0.02 NA | |
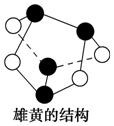
| B. | 0.5 mol雄黄(As4S4,所有原子都满足8电子结构,结构如图)含有NA个S-S键 | |
| C. | 39 g苯分子中共含6 NA个共价单键 | |
| D. | 向FeI2、NaBr的混合溶液中通入适量氯气,当有1 molFe2+被氧化时,该反应转移电子的数目至少为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)
(1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
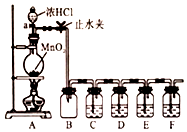 某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:
某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
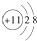 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 | |
| B. | 对2SO2+O2?2SO3△H<0的反应,使用催化剂可加快反应的速率 | |
| C. | 实验室可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,500℃左右比室温更有利于合成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 标准状况下,lmol H2所占体积约为22.4L,lmol H2和N2混合气体的体积也约为22.4L | |
| C. | 0.1L0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA | |
| D. | 2.3gNa在足量O2中燃烧,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
下列分离物质的方法不 正确的是( )
正确的是( )
A.用蒸发结晶的方法分离碳酸钠和水
B.用过滤的方法分离植物油和水
C.用蒸馏的方法分离酒精 和水
和水
D.用萃取和分液的方法用CCl4从碘水中提取碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com