
| A. | Cu做还原剂 | B. | H2做氧化剂 | ||
| C. | 铜元素的化合价降低 | D. | 铜是氧化产物 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 气态氢化物共价键越强,热稳定性越高 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氢键是化学键的一种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物溶于水后的溶液中pH<7,则为成酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋白质多是酸性食物;蔬菜、水果多是碱性食物 | |
| C. | 大米是碱性食物 | |
| D. | 柠檬是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 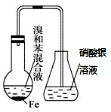 验证苯和液溴在催化剂作用下发生取代反应 | |
| B. | 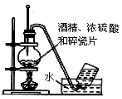 实验室制备并收集乙烯 | |
| C. | 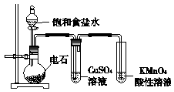 制备乙炔并检验其性质 | |
| D. | 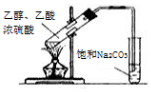 乙醇与乙酸反应制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 苯(苯酚):加入浓溴水,过滤 | |
| C. | 乙醇(水):加入金属钠,蒸馏 | |
| D. | 乙烷(乙烯):通入酸性高锰酸钾溶液,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
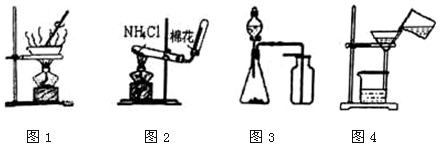
| A. | 用图1所示装置进行食盐溶液的蒸发结晶 | |
| B. | 用图2所示装置在实验室制取少量氨气 | |
| C. | 用图3所示装置制取少量CO2、O2或NO | |
| D. | 用图4所示装置进行固液物质的分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com