
| A. | 10s内,NH3的平均反应速率为0.008mol•L-1•s-1 | |
| B. | 该反应达到平衡时6v(O2)正=5v(H2O)逆 | |
| C. | 10s内,反应放出的热量为0.1akJ | |
| D. | 10s时,H2O的反应速率为0.012mol•L-1•s-1 |
分析 10s时水蒸气的物质的量增加了0.60mol,则用水蒸气表示的平均反应速率为:v(H2O)=$\frac{\frac{0.6mol}{5L}}{10s}$=0.012mol•L-1•s-1,
A.根据化学反应速率与化学计量数成正比计算出用氨气表示的平均反应速率;
B.达到平衡时正逆反应速率相等,该关系不满足计量数之比;
C.根据生成0.6mol水蒸气放出akJ热量计算;
D.根据分析判断水的反应速率.
解答 解:10s时水蒸气的物质的量增加了0.60mol,则用水蒸气表示的平均反应速率为:v(H2O)=$\frac{\frac{0.6mol}{5L}}{10s}$=0.012mol•L-1•s-1,
A.10s内,NH3的平均反应速率为:v(NH3)=$\frac{4}{6}$v(H2O)=0.012mol•L-1•s-1×$\frac{4}{6}$=0.008mol•L-1•s-1,故A正确;
B.6v(O2)正=5v(H2O)逆,正逆反应速率相等,达到平衡状态,故B正确;
C.根据4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ/mol可知,生成0.6mol水蒸气放出的热量为:akJ/mol×$\frac{0.6mol}{6}$=0.1akJ,故C正确;
D.根据分析可知,10s内H2O 的平均反应速率为0.012mol?L-1?s-1,并不是10s时的反应速率,故D错误;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学平衡状态的特征及判断方法,试题有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
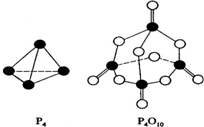 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应混合物的浓度改变 | B. | 反应混合物的压强改变 | ||
| C. | 正、逆反应速率改变 | D. | 反应物的转化率改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 除去粗盐中的Mg2+应加入过量的KOH,然后过滤 | |
| D. | 粗盐提纯最后一步应向滤液中加入盐酸,调节溶液的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △S>0 | |
| B. | 产物CO 为酸性氧化物 | |
| C. | 高温条件下才能自发进行 | |
| D. | 采用碎沙而非石块的原因可能是加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+,K+,MnO4-,Cl- | B. | Na+,H+,NO3-,SO42- | ||
| C. | K+,Ca2+,NO3-,CO32- | D. | Cu2+,Na+,Cl-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | ① | ② | ③ | ④ | ③ | ⑥ |
| 仪器及装置图 |  |  |  |  |  |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com