
(每空2分,共12分)下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: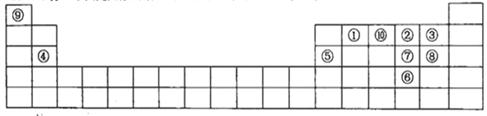
(1)在这10种元素中,非金属性最强的是___________(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为______________________,元素②与⑨形成的18e-化合物的电子式____________________;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有___________________________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:____>____(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式______________________。
(1)③ ;H-O-Cl;(2)H—O—Cl ; 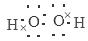 ;
;
(3)离子键和共价键; (4)HCl>H2S ; (5)Al2O3+2OH- = 2AlO2- +H2O
解析试题分析:(1)根据元素在周期表中的位置可知:在这10种元素中,非金属性最强的是③F元素;(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为H-O-Cl;元素②与⑨形成的18e-化合物H2O2的电子式是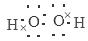 ,(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M:NH4NO3中含有的化学键类型有离子键、极性共价键;(4)由于非金属性Cl>S,所以元素⑦⑧形成的气态氢化物的稳定性:HCl>H2S ;(5)元素⑤Al的氧化物与氢氧化钠溶液反应的离子方程式是l2O3+2OH- = 2AlO2- +H2O。
,(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M:NH4NO3中含有的化学键类型有离子键、极性共价键;(4)由于非金属性Cl>S,所以元素⑦⑧形成的气态氢化物的稳定性:HCl>H2S ;(5)元素⑤Al的氧化物与氢氧化钠溶液反应的离子方程式是l2O3+2OH- = 2AlO2- +H2O。
考点:考查元素的推断、元素周期律的应用、元素形成的化合物的结构、性质及化学用语的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下列说法中正确的是
| A.第三周期所包含的元素中钠的原子半径最小 |
| B.钠的第一电离能比镁的第一电离能大 |
| C.在所有元素中,氟的电负性最大 |
| D.电子云示意图中的每个小黑点都表示一个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列排列顺序正确的是( )
① 热稳定性:H2O>HF>H2S ② 原子半径:Na>Mg>O
③ 酸性:H3PO4>H2SO4>HClO4 ④ 熔沸点:H2O>HF>HCl
| A.①③ | B.②④ | C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)写出下列元素的元素名称:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
| A | | C |
| | B | |
 反应的化学方
反应的化学方 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属。试回答:
(1)C在元素周期表的第_____周期________族。
(2)在五种元素中,能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是(用具体的分子式表示) 。
(3)A与B形成的三原子分子的结构式是 ,B与D形成的原子个数比为1∶1的化合物的电子式是 。
(4)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1 :2。肼—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。该燃料电池的正极的电极反应式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)原子序数依次增大的短周期元素A、B、C、D、E、F,其中 A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能形成与A相同价态的阴离子,且A离子半径小于F离子。回答:
(1)B元素的名称为 。
(2)A与F可形成两种中学化学常见的化合物,其分子式分别为 和 ;分子空间构型分别为 。
(3)请写出基态原子E的价电子排布式
(4)上述六种元素按电负性从大到小的排列是 (写元素符号表示)。
(5)C、D、E、F元素第一电离能从小到大的排列是 (写元素符号);
(6)A、B、C、D四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)__________________________。
(7)C与A形成的化合物属于 晶体,此化合物和NaCl固体相比较熔点的高低关系为
(用化学式表示大小关系),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
(1)①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,热稳定性最差的是__________(用化学式表示,下同);还原性最强的是_____________。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)
④D、F、Z形成一种离子化合物,写出它的电子式________________________。
(2)①2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
②F、X形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,,则该物质的化学式为___________。
③Z单质和FD3发生置换反应,观察到有大量白烟生成,写出该反应化学方程式__________,反应中氧化剂和还原剂物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下图是元素周期表短周期中11种元素的化台价与原子序数的关系示意图,请回答下列问题(用具体的元素符号作答):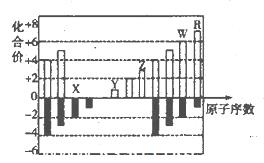
(1)元素x、Y、z、W、R五种元素中属于金属元素的是___________;Z的简单离子的结构示意图是___________。
(2)由此图可以判断,11种元素中处于同主族的共有____________组。
(3)X、Y.Z三种元素的原子半径大小顺序为___________;它们的离子的半径大小顺序为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com