
 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.分析 (1)A.锌锰干电池碳棒不发生变化;
B.氢氧燃料电池可将化学能直接转变为电能;
C.甲烷燃料电池工作时甲烷在负极被氧化;
D.太阳能电池的主要材料是高纯度的硅.
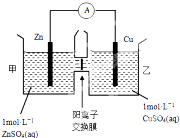
(2)由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大;
(3)酸性氢氧燃料电池在正极上放电的是氧气,电极反应式:O2+4e-+4H+=2H2O;碱式氢氧燃料电池在负极放电的是氢气,负极反应式为:H2-2e-+2OH-=2H2O;
(4)碳酸酸性比次氯酸强,二氧化碳与次氯酸钙反应生成碳酸钙和次氯酸;洁厕剂主要成分为盐酸,与次氯酸钙反应生成氯化钙和氯气;
(5)在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁,生成高铁酸钾,结合质量守恒平衡;
(6)负极锌被氧化.
解答 解:(1)A.锌锰干电池碳棒不发生变化,起到导电作用,故A错误;
B.氢氧燃料电池可将化学能直接转变为电能,故B错误;
C.甲烷燃料电池工作时甲烷在负极被氧化,氧气为正极,故C正确;
D.太阳能电池的主要材料是高纯度的硅,故D错误.
故答案为:C;
(2)A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A错误;
B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B错误;
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故C正确;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,乙池消耗铜,溶液质量增大,故D正确,
故答案为:CD;
(3)氢氧燃料电池无论是酸式还是碱式,其电池总反应均为:2H2+O2=2H2O ①,
酸式氢氧燃料电池负极电极反应式为:2H2-4e-=4H+②,用(①-②)即得酸式氢氧燃料电池的正极反应:O2+4H++4e-=2H2O,溶液体积增大,氢离子浓度减小,则pH增大,
故答案为:O2+4e-+4H+=2H2O;变大;
(4)碳酸酸性比次氯酸强,二氧化碳与次氯酸钙反应生成碳酸钙和次氯酸,反应的离子方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,生成次氯酸不稳定,见光易分解,发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,洁厕剂主要成分为盐酸,与次氯酸钙反应生成氯化钙和氯气,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;ClO-+Cl-+2H+=Cl2↑+H2O;
(5)在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁,生成高铁酸钾,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=3Cl-+2FeO42-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=3Cl-+2FeO42-+5H2O;
(6)由总方程式可知负极锌被氧化生成氧化锌,电极方程式为Zn-2e-+2OH-=ZnO+H2O,故答案为:Zn-2e-+2OH-=ZnO+H2O.
点评 本题综合考查对电化学以及元素化合物知识,为高考常见题型和高频考点,侧重于学生的分析能力和元素化合物知识的理解和运用的考查,注意把握物质的性质和应用,注意相关基础知识的积累,把握原电池、电解池的工作原理,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
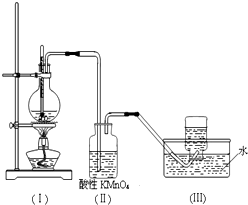 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
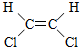 与
与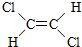 两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )| A. | 1,1-二氯乙烯 | B. | 丙烯 | C. | 2-丁烯 | D. | 1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
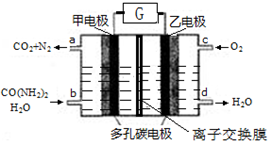
| A. | 甲电极是阴极 | B. | 电解质溶液可以是KOH溶液 | ||
| C. | H+从甲电极附近向乙电极附近迁移 | D. | 每2molO2理论上可净化1molCO(NH2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3、Ba(NO3)2、NH4NO3、AgNO3 | B. | HNO3、NH4NO3、Ba(NO3)2、AgNO3 | ||
| C. | NH4NO3、HNO3、Ba(NO3)2、AgNO3 | D. | NH4NO3、HNO3、AgNO3、Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取某试样溶液少量,加入KSCN溶液无明显现象,再滴入几滴氯水,若溶液显血红色,说明原试样中含Fe2+ | |
| B. | 淀粉溶液和稀硫酸共热后,加碱中和,再加少量银氨溶液水浴加热,有光亮的银镜生成 | |
| C. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共沸几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com