
【题目】姜黄素是从姜科植物中提取的一种色素,它的主要药理作用有抗氧化、保肝护肝、抑制肿瘤生长等,它具有对称性结构。

己知:E、G能发生银镜反应![]() (R、R、R"表示烃基或氢原子)
(R、R、R"表示烃基或氢原子)
请根据以上信息回答下列问题:
(1)生成A的反应类型是______,试剂X的名称是_________。
(2)写出下列反应的化学方程式
A→B:_____________;E→F:_____________。
(3)G的核磁共振氢谱峰面积之比________。
(4)J(C8H8O3)的同分异构体中同时满足如下条件:① 能与NaHCO3反应,② 能使FeCl3溶液显色,共有______种(不考虑立体异构),其中苯环上的一氯代物有两种的同分异构体的结构简式是_______。
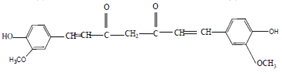
(5)姜黄素的结构简式___________。
【答案】 加成反应 氢氧化钠溶液 CH2BrCH2Br+2H2O![]() CH2OHCH2OH+2HBr(或CH2BrCH2Br+2NaOH
CH2OHCH2OH+2HBr(或CH2BrCH2Br+2NaOH![]() CH2OHCH2OH+2NaBr) 2CH3CHO
CH2OHCH2OH+2NaBr) 2CH3CHO![]() CH3CH=CHCHO+H2O 1:2:2:3 13 ;
CH3CH=CHCHO+H2O 1:2:2:3 13 ;![]()
【解析】乙烯与溴发生加成反应生成A,A为BrCH2CH2Br,A发生反应得到B,B可以连续发生氧化反应,则A在氢氧化钠水溶液、加热条件下水解得到B,B为HOCH2CH2OH,C为OHC-CHO,D为OHC-COOH,结合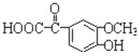 ,由Y分子式可知Y为
,由Y分子式可知Y为![]() ,
, 脱羧得到J(C8H8O3),则J为
脱羧得到J(C8H8O3),则J为![]() ,J与CH3COCH2COCH3得到姜黄素(C21H20O6),结合信息可知姜黄素为
,J与CH3COCH2COCH3得到姜黄素(C21H20O6),结合信息可知姜黄素为![]() 。乙烯与氧气反应得到E,E可以发生银镜反应,则E为CH3CHO,结合选项可知F为CH3CH=CHCHO,F与氢气发生加成反得到G,G可以发生银镜反应,则G为CH3CH2CH2CHO。
。乙烯与氧气反应得到E,E可以发生银镜反应,则E为CH3CHO,结合选项可知F为CH3CH=CHCHO,F与氢气发生加成反得到G,G可以发生银镜反应,则G为CH3CH2CH2CHO。
(1)根据以上分析可知生成A的反应类型是加成反应,试剂X的名称:氢氧化钠水溶液。(2)根据以上分析可知A生成B的方程式为CH2BrCH2Br+2NaOH![]() CH2OHCH2OH+2NaBr。E→F的化学反应方程式为2CH3CHO
CH2OHCH2OH+2NaBr。E→F的化学反应方程式为2CH3CHO![]() CH3CH=CHCHO+H2O。(3)G的结构简式为CH3CH2CH2CHO,因此核磁共振氢谱峰面积之比为1:2:2:3;(4)J(
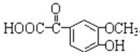
CH3CH=CHCHO+H2O。(3)G的结构简式为CH3CH2CH2CHO,因此核磁共振氢谱峰面积之比为1:2:2:3;(4)J(![]() )的同分异构体中同时满足如下条件:①能与NaHCO3反应,含有羧基,②能使FeCl3溶液显色,含有酚羟基,侧链为-OH、-CH2COOH,有邻、间、对3种,侧链可以为-OH、-CH3、-COOH,-OH、-CH3处于邻位,-COOH有4种位置,-OH、-CH3处于间位,-COOH有4种位置,-OH、-CH3处于对位,-COOH有2种位置,符合条件的同分异构体共有13种,其中苯环上的一氯代物有两种的同分异构体的结构简式为
)的同分异构体中同时满足如下条件:①能与NaHCO3反应,含有羧基,②能使FeCl3溶液显色,含有酚羟基,侧链为-OH、-CH2COOH,有邻、间、对3种,侧链可以为-OH、-CH3、-COOH,-OH、-CH3处于邻位,-COOH有4种位置,-OH、-CH3处于间位,-COOH有4种位置,-OH、-CH3处于对位,-COOH有2种位置,符合条件的同分异构体共有13种,其中苯环上的一氯代物有两种的同分异构体的结构简式为![]() ;(5)根据以上分析可知姜黄素的结构简式为
;(5)根据以上分析可知姜黄素的结构简式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主。已知砷化镓的晶胞结构如图。试回答:
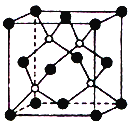
(1)镓的基态原子的外围电子排布式是_______________。
(2)镓与钾、钙元素的第一电离能从大到小依次为_________________________,与其在同一周期的砷、硒和溴的电负性从大到小依次为_______________。(填元素符号)
(3)此晶胞中所含的砷原子(白色球)个数为_______,与同一个镓原子相连的砷原子构成的立体构型为___________,镓采取的杂化方式为________________。
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为_____________________,其结构式为_____________,硼酸是_______元酸。
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为________cm,NA表示阿伏伽德罗常数,则该晶体的密度为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)Ba(OH)2:_______________________________________。
(2)KHSO4:________________________________________。
(3)HNO3:_________________________________________。
(4)Na2CO3:_______________________________________。
(5)NaHCO3:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于标准状况下11.2L CO2的说法正确的是( )
A.质量为44gB.CO2物质的量为1mol
C.含有1mol氧原子D.CO2分子数为3.01×1024
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明氯原子得电子能力比硫原子强的是
①HC1的溶解度比H2S大
②HC1的酸性比H2S强
③HCl的稳定性比H2S强
④HC1的还原性比H2S强
⑤HC1O的酸性比H2SO4强
A. ①②⑤ B. ③④ C. ③ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g)。
2C1NO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
(3)300℃时,2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
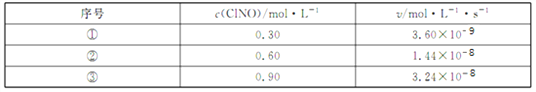
n =____________;k =__________________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①该反应的ΔH ____________0(填“>”、“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min);
③T2时该反应的平衡常数K=____________。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其用途相符合的是
①Cl2——自来水消毒剂 ②浓硫酸——干燥剂 ③AgI——人工降雨
④FeCl3——印刷电路板 ⑤淀粉——检验I2的存在 ⑥Na2O2——漂白纺织物
A. ②③④⑤⑥ B. ①②③④⑤ C. ②③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 在沸水中滴入含0.1mol FeC13的FeC13饱和溶液,制得Fe(OH)3胶粒数为0.1 NA
B. lmol O2参加反应转移电子数一定为4NA
C. lmol铁和标准状况下22.4L C12充分反应,转移的电子数为3NA
D. 常温常压下,32g O2含有的氧原子数为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com