
【题目】已知:A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均己略去。
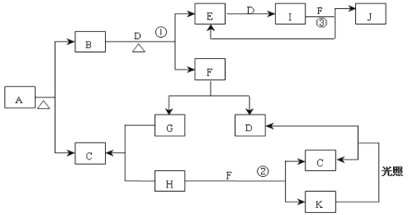
(1)写出它们的化学式:A__、C__、J__。
(2)写出②的离子反应方程式:__。
(3)写出③的化学反应方程式:__。
(4)红热的碳与J的浓溶液反应的化学方程式:__。
(5)J的浓溶液与单质Ag反应的离子方程式为:__。
(6)若86.4g银与含有1.4molJ的浓溶液恰好完全反应,则最终得到气体(NO、NO2)的总物质的量为__mol。
【答案】NH4Cl HCl HNO3 Cl2+H2O=H++Cl-+HClO 3NO2+H2O=2HNO3+NO C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O Ag+2H++NO3-=Ag++NO2↑+H2O 0.6
CO2↑+4NO2↑+2H2O Ag+2H++NO3-=Ag++NO2↑+H2O 0.6
【解析】
气体B能使湿润红色石蕊试纸变蓝,B是氨气;气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,则E是NO、I是NO2,D是O2;J的水溶液为强酸,J是HNO3,F是液体,NO2与水反应生成硝酸,F是H2O,G是氢气;H为黄绿色气体,H是Cl2;Cl2和水反应生成盐酸和次氯酸,次氯酸光照条件下分解为盐酸和氧气,则C是HCl、K是HClO;A是NH4Cl。
(1)A是氯化铵,化学式是NH4Cl、C是氯化氢,化学式是HCl;J是硝酸,化学式是HNO3;
(2)②是氯气和水反应生成盐酸和次氯酸,反应的离子反应方程式是Cl2+H2O=H++Cl-+HClO;
(3)③是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学反应方程式是3NO2+H2O=2HNO3+NO;
(4)红热的碳与浓硝酸反应生成二氧化碳、二氧化氮和水,反应的化学方程式是C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(5)浓硝酸与Ag反应生成硝酸银、二氧化氮、水,反应的离子方程式为Ag+2H++NO3-=Ag++NO2↑+H2O;
(6)86.4g银的物质的量是![]() ,生成硝酸银的物质的量是0.8mol,根据氮元素守恒,最终得到气体(NO、NO2)的总物质的量为1.4mol-0.8mol=0.6mol。
,生成硝酸银的物质的量是0.8mol,根据氮元素守恒,最终得到气体(NO、NO2)的总物质的量为1.4mol-0.8mol=0.6mol。


科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子在溶液中可以大量共存,且加入或通入试剂M后,发生反应的离子方程式也正确的是
选项 | 微粒组 | 试剂M | 发生反应的离子方程式 |
A | K+、Na+、 | 少量HCl | 2H++ |
B |
| 过量H2S | Fe2++H2S |
C | HClO、Na+、Fe3+、 | 过量CaCl2 | Ca2++ |
D |
| 少量CO2 | CO2+2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1NaOH溶液:Na+、K+、![]() 、
、![]()
B. 0.1 mol·L1FeCl2溶液:K+、Mg2+、![]() 、
、![]()
C. 0.1 mol·L1K2CO3溶液:Na+、Ba2+、Cl、OH
D. 0.1 mol·L1H2SO4溶液:K+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )

A.H3PO4的电离方程式为:H3PO4![]() 3H++ PO43
3H++ PO43
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4、HPO42、PO43
C.滴加NaOH溶液至pH=7,溶液中c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4 =2Na3PO4+3H2O+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)家用液化气的主要成分之一是丁烷(C4H10),当1 kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:________
(2)已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为_______________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H=—24.8 kJ·mol-1
3Fe2O3 (s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=—47.4 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)体和CO2(g)的热化学反应方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是

A.HA一定是弱酸
B.BOH可能是强碱
C.z点时,水的电离被促进
D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧硫化碳(COS,结构类似于CO2)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱氧硫化碳中的硫,其中氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g) + H2(g)H2S(g) + CO(g) ΔH1= + 7kJ/mol
②水解反应:COS(g) + H2O(g)H2S(g) + CO2(g) ΔH2= -35 kJ/mol
请回答下列问题:
(1)氧硫化碳的电子式为____________。
(2)CO2和H2能反应生成CO和H2O(g),写出该反应的热化学方程式______________。
(3)在密闭恒温(高于100℃)恒容装置中进行水解反应,下列能说明达到平衡状态的是___________________。
A.混合气体密度不再改变 B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变 D. COS(g) 的浓度不变
(4)①上述氢解反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②某温度下,体积为2L的恒容体系中,物质的量分别为m mol、n mol的COS蒸气和H2气发生氢解,已知COS的转化率为α,则该温度下的平衡常数K=___________(用m、n、α等符号表示)。
(5)某科研小组研究改进催化剂TiO2/Al2O3和温度对COS水解的影响,得到如图图像:

COS水解的最佳温度是 __________ ;理由是 ________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com