
| A. | 0.1 mol•L-1 NH4HS溶液中有:c(NH4+)<c(HS-)+c(S2-)+c(H2S) | |
| B. | 在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) | |
| C. | 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) | |
| D. | 等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH4+)的大小关系:①>③>② |
分析 A.溶液中存在物料守恒,n(N)=n(S);
B.溶液中c(Na+)=n(SO42-),溶液中存在阴阳离子电荷总数相同;
C.等浓度的HCN和NaCN混合溶液中有物料守恒分析判断;
D.从两个角度考虑,一是相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,以此来解答.
解答 解:A.0.1 mol•L-1 NH4HS溶液中有存在物料守恒,c(NH4+)+c(NH3•H2O)=c(HS-)+c(S2-)+c(H2S),则c(NH4+)<c(HS-)+c(S2-)+c(H2S),故A正确;
B.溶液中硫酸氢钠完全电离,c(Na+)=n(SO42-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+2c(SO42-),c(H+)=c(OH-)+c(SO42-),故B正确;
C.等浓度的HCN和NaCN混合溶液中有物料守恒:2c(Na+)=c(CN-)+c(HCN),故C正确;
D.相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,:①=③>②,故D错误;
故选D.
点评 本题考查了电解质溶液中电荷守恒、物料守恒、盐类水解、影响平衡的因素等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 1molNa2O2溶于水转移的电子数为2NA | |
| D. | 含4 mol HCl的浓盐酸与足量的二氧化锰反应,生成Cl2分子的数目为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铁件上镀铜,镀件连接电源的正极,用含Cu2+的盐溶液作电解质溶液 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
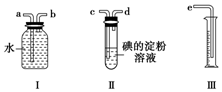 已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.
已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示反应N2 (g)+3H2(g)?2NH3(g)△H<0的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
如图表示反应N2 (g)+3H2(g)?2NH3(g)△H<0的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )| A. | tl时减小了压强 | |
| B. | t1时降低了温度 | |
| C. | tl时减小N2滚度,同时增加了NH3的浓度 | |
| D. | t1时减小了NH3的浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测量氯化钠的熔点 | B. | 测量固体氯化钠的导电性 | ||
| C. | 测量熔融氯化钠的导电性 | D. | 测量氯化钠水溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
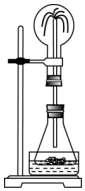 在如图锥形瓶外一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉.水槽中加入的物质可以是( )
在如图锥形瓶外一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉.水槽中加入的物质可以是( )| A. | 生石灰 | B. | 食盐 | C. | 蔗糖 | D. | 固体NH4NO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com