
2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中存在Fe3+和Fe2+ B.1.12L气体是NO、NO2的混合气体
C.反应后溶液中c(NO3-)=0.85mol·L-1 D.反应后的溶液最多还能溶解1.4gFe
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三上学期期中考试化学试卷(解析版) 题型:选择题
化工生产中通常有“三酸两碱”之说,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是__________,(填化学式)。
(2)向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是__________(填序号)。
A.浓H2SO4具有脱水性
B.盐酸具有挥发性
C.气体溶质的溶解度随温度升高而降低
(3)“三酸”常用于溶解金属和金属氧化物
①下列块状金属在常温下能够全部溶于足量的浓硝酸的是______(填序号);
A.Au B.Ag C.Al D.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式__________________________。
(4)烧碱、纯碱溶液均可吸收CO2气体。当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温小于蒸干,称得固体质量为8g,则所得固体是____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
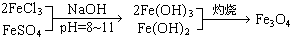
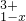 ?
?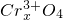 ],现有15.2g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为______.
],现有15.2g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为______.查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com