
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
分析 (1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应;
(2)反应③是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,结合温度变化分析判断反应焓变△H<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;所以△H3═△H1+△H2;
(3)A.缩小反应容器的容积,压强增大,平衡向气体体积减小的方向移动;
B.扩大反应容器的容积,压强减小,平衡向气体增大的方向移动;
C.升高温度,平衡向吸热反应方向移动,根据K3=K1×K2判断温度对平衡移动影响;
D.由于K3=K1×K2,由表中数据可知,降低温度平衡常数增大,平衡正向移动;
E.使用合适的催化剂,不影响平衡移动;
F.从平衡体系中及时分离出CH3OH,平衡正向移动;
(4)500℃时K3=K1×K2=2.5,再计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v(正)、v(逆)相对大小;
(5)依据反应能量变化结合平衡移动原理和影响因素分析选项;
(6)依据影响化学反应速率的因素分析判断反应速率变化和反应进行方向绘制图象.
解答 解:(1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应,
故答案为:吸热;
(2)反应①+②可得反应③,则平衡常数K3=K1×K2,反应③是气体体积减小的反应△S<0,反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.52×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,所以反应在低温下能自发进行,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;所以△H3═△H1+△H2;
故答案为:K1×K2;△H3═△H1+△H2;<;较低;
(3)A.缩小反应容器的容积,缩小反应容器的容积,压强增大,平衡向正向移动,故正确;
B.扩大反应容器的容积,扩大反应容器的容积,压强减小,平衡逆向移动,故错误;
C.由于K3=K1×K2,由表中数据可知,升高温度平衡常数减小,平衡逆向移动,故错误;
D.由于K3=K1×K2,由表中数据可知,降低温度平衡常数增大,平衡正向移动,故正确;
E.使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故错误;
F.从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故正确,
故选:ADF;
(4)500℃时K3=K1×K2=2.5,浓度商Qc=$\frac{0.3×0.15}{0.1×0.{3}^{3}}$=16>K=2.5,反应向逆反应进行,故v(正)<v(逆),
故答案为:<;
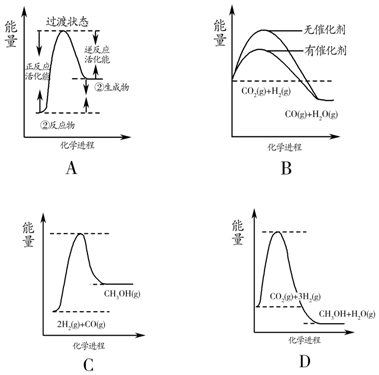
(5)A、反应②已经平衡常数随温度变化分析为吸热反应,反应物能量低于生成物,图象符合,故A正确;
B、催化剂改变反应速率不改变化学平衡,平衡状态不变,图象不符合,故B错误;
C、①2H2(g)+CO(g)?CH3OH(g),依据数据分析,平衡常数随温度 升高减小,说明正反应为放热反应,反应物能量高于生成物,图象不符合,故C错误;
D、反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是放热盐,反应物能量高于生成物,图象符合,故D正确;
故答案为:AD;
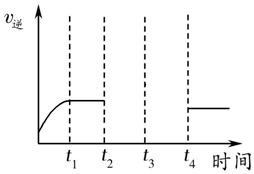
(6)反应②CO2(g)+H2(g)?CO(g)+H2O(g)是气体体积不变的吸热反应,反应的逆反应速率在下列不同条件随时间的变化曲线,开始时升温,逆反应速率增大,t1时平衡,t2时降压,逆反应速率减小,平衡不变,t3时增加CO浓度,此时刻逆反应速率增大,随反应进行减小,大平衡状态大于t2-t3平衡状态的逆反应速率,t4时又达到平衡,依据反应速率影响分析绘制出去下变化;画出t2至t4的曲线为如图所示 ;
;
故答案为: .
.
点评 本题考查了化学平衡、反应速率影响因素分析判断,平衡常数计算应用,掌握反应特征和平衡移动原理是关键,题目难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 使用天然气热水器取代电热水器 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 在0.l mol•L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(c{l}^{-})}$>1 | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、环己烷都属于脂肪烃 | B. | 苯、环戊烷、环己烷同属于芳香烃 | ||
| C. | 乙烯、乙炔同属于烯烃 | D. |  、 、 、 、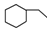 同属于环烷烃 同属于环烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,0.5 mol任何气体的体积都必定是11.2 L | |
| B. | 在标准状况下,1 mol任何物质的体积都约是22.4 L | |
| C. | 常温常压下,1 mol任何气体的体积都约是22.4 L | |
| D. | 在标准状况下,0.5 mol CO2所占有的体积约是11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com