
【题目】某新型药物H(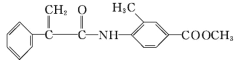 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:
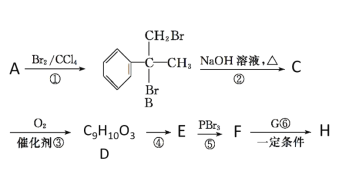
已知:①E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色;
②RCOOH![]()
![]() (R为烃基);
(R为烃基);
③![]()
![]()
![]() 。
。
请回答下列问题:
(1)A的结构简式为________;D的官能团的名称为____________。
(2)①的反应类型是________。
(3)写出B→C的化学方程式: ______________________________________。
(4)E有多种同分异构体,同时满足下列条件的E的同分异构体的结构简式_______。
ⅰ.能发生银镜反应
ⅱ.能发生水解反应
ⅲ.分子中含的环只有苯环,且苯环上只有一个取代基。
(5)参照合成H的上述路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线。
________________________________________________
【答案】![]() 羟基、羧基 加成反应
羟基、羧基 加成反应 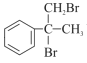 +2NaOH
+2NaOH![]()
 +2NaBr
+2NaBr  CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]()
![]()
![]() CH3CONHCH(CH3)2
CH3CONHCH(CH3)2
【解析】
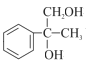
A与溴单质发生加成反应,根据B的结构得到A的结构简式为![]() ,B(
,B(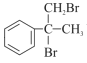 )发生水解反应生成醇,
)发生水解反应生成醇, 催化氧化,只有—CH2OH的醇被氧化,根据D的分子式得到D(
催化氧化,只有—CH2OH的醇被氧化,根据D的分子式得到D(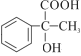 ),根据已知信息得到F和G发生反应生成H,根据H的结构简式得到F(
),根据已知信息得到F和G发生反应生成H,根据H的结构简式得到F(![]() )和G(
)和G(![]() ),则D发生消去反应得到E(
),则D发生消去反应得到E(![]() )。
)。
根据A与溴单质发生加成反应,再根据B的结构简式得到A的结构简式为![]() ,D结构简式为
,D结构简式为 ,其官能团的名称为羟基、羧基;故答案为:
,其官能团的名称为羟基、羧基;故答案为:![]() ;羟基、羧基。
;羟基、羧基。
⑵根据前面分析得到①的反应类型是加成反应;故答案为:加成反应。
⑶B→C是发生水解反应,其化学方程式: +2NaOH
+2NaOH![]()
 +2NaBr;故答案为:
+2NaBr;故答案为: +2NaOH
+2NaOH![]()
 +2NaBr。
+2NaBr。
⑷E的结构简式![]() ,E有多种同分异构体,能发生银镜反应,说明有醛基;能发生水解反应,说明有酯基且为甲酸酯;分子中含的环只有苯环,且苯环上只有一个取代基,则
,E有多种同分异构体,能发生银镜反应,说明有醛基;能发生水解反应,说明有酯基且为甲酸酯;分子中含的环只有苯环,且苯环上只有一个取代基,则![]() 、
、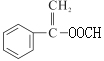 ;故答案为:
;故答案为:![]() 、
、 。
。
⑸乙醛催化氧化变为乙酸,乙酸和三溴化磷反应生成CH3COBr,CH3COBr与NH2CH(CH3)2在一定条件下反应生成CH3CONHCH(CH3)2,其合成路线为:CH3CHO![]() CH3COOH
CH3COOH![]()
![]()
![]() CH3CONHCH(CH3)2;故答案为:CH3CHO
CH3CONHCH(CH3)2;故答案为:CH3CHO![]() CH3COOH
CH3COOH![]()
![]()
![]() CH3CONHCH(CH3)2。
CH3CONHCH(CH3)2。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质,化合物之间的转化关系图,有些反应中的部分物质被唔去,常温常压下:A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应![]() 均为工业上的重要反应:
均为工业上的重要反应:

请回答下列问题:
(1)![]() 的化学式为 ______ .
的化学式为 ______ .
(2)写出C和NaOH溶液反应生成L的离子方程式: ______ ;
(3)写出B与C高温反应生成E和F的化学方程式: ______ ;
(4)写出D与J的稀溶液反应生成G的离子方程式: ______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,改变0.1mol·L-1的富马酸(H2A)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)[ δ(X)= ![]() ]随pH的变化如图所示。下列叙述正确的是( )
]随pH的变化如图所示。下列叙述正确的是( )

A.pH=3.05时,c(H2A)=c(HA-)=c(OH-)B.pH=4.0时, c(HA-)>C(H2A)>c(A2-)
C.常温下,反应HA-+OH-![]() A2-+H2O的pK=9.51D.常温下,图中x点处:1g
A2-+H2O的pK=9.51D.常温下,图中x点处:1g![]() =0.72
=0.72
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常见有机物说法正确的是![]()
A.糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物
B.除去乙醇中少量的乙酸:加入足量生石灰,蒸馏
C.乙醇和苯都不能使溴的四氯化碳溶液和酸性![]() 溶液褪色
溶液褪色
D.石油裂化的主要产品是甲烷、乙烯和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH= 3的乙酸溶液,下列说法正确的是
A.c(H+)=c(CH3COO-)+c(OH-)
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH降低
D.与等体积pH=11的NaOH溶液混合后所得溶液中c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)3Fe(C6H5O7)2(柠檬酸铁铵)广泛用于医学、食品业等。实验室由硫酸亚铁和柠檬酸(  )等为原料制备柠檬酸铁铵产品的主要实验流程如图:
)等为原料制备柠檬酸铁铵产品的主要实验流程如图:
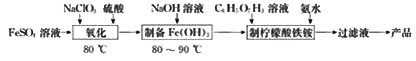
回答下列问题:
(1)“氧化”时,发生反应的离子方程式为________(ClO3-转化为Cl-)。
(2)氧化后的溶液¨制备Fe(OH)3”的详细实验操作为:在不断搅拌下,向氧化后的溶液中________。
(3)“制备柠檬酸铁铵”的装置(夹持及加热装置已略)如图所示

①图中仪器W的名称是________。
②Fe(OH)3与柠檬酸反应时温度需控制在65℃,适宜的加热方法是________;待Fe(OH)3完全溶解后,需将温度降到40℃后再滴加氨水,釆用较低温度滴加氨水,其原因是________ 。
③合适的尾气吸收装置是________(填字母)。
(4)由“过滤液”得到产品还需经过的操作是蒸发浓缩、冷却结晶、________、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
![]()
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
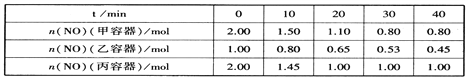
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
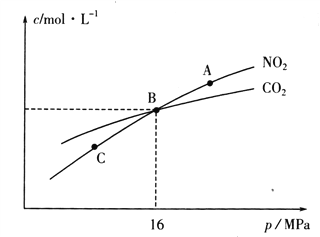
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
![]() 时溶解度
时溶解度![]() 克
克![]() 克水
克水![]() ,
,![]() :111,
:111,![]() :
:![]()
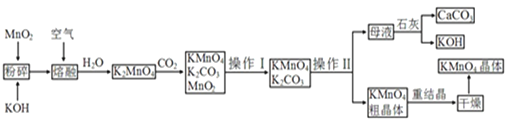
![]() 稀溶液是一种常用的消毒剂,其消毒原理与下列____物质相似。
稀溶液是一种常用的消毒剂,其消毒原理与下列____物质相似。
A ![]() 酒精
酒精 ![]() 双氧水
双氧水 ![]() 苯酚
苯酚 ![]() “84”消毒液
“84”消毒液![]() 溶液
溶液![]()
![]() 操作Ⅰ的名称是____;操作Ⅱ是根据
操作Ⅰ的名称是____;操作Ⅱ是根据![]() 和
和![]() 两物质在____
两物质在____![]() 填性质
填性质![]() 上差异,采用____
上差异,采用____![]() 填操作步骤
填操作步骤![]() 、趁热过滤得到
、趁热过滤得到![]() 粗晶体的。
粗晶体的。
![]() 上述流程中可以循环使用的物质有石灰、
上述流程中可以循环使用的物质有石灰、![]() 、____和____
、____和____![]() 写化学式
写化学式![]() 。
。
![]() 向
向![]() 溶液中通入
溶液中通入![]() 以制备
以制备![]() ,该反应中的还原剂是_________。
,该反应中的还原剂是_________。
![]() 铋酸钠
铋酸钠![]() ,不溶于水
,不溶于水![]() 用于定性检验酸性溶液中
用于定性检验酸性溶液中![]() 的存在
的存在![]() 铋元素的还原产物为
铋元素的还原产物为![]() ,Mn的氧化产物为
,Mn的氧化产物为![]() 价
价![]() ,写出反应的离子方程式_________。
,写出反应的离子方程式_________。
![]() 写出
写出![]() 、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式___________。
、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式___________。
![]() 若不考虑物质循环与制备过程中的损失,则
若不考虑物质循环与制备过程中的损失,则![]() 可制得____
可制得____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
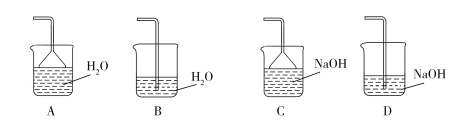
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com