
(12分)【化学——化学与技术】合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分。请回答下列问题:
(1)右图是工业制硫酸的流程示意图: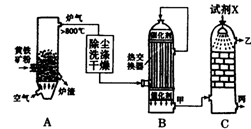
①设备A的名称为 。
②试剂X为 。
③B设备中热交换器的作用是 。
(2)工业制硝酸时,酸吸收塔中的水吸收NO2是放热反应,为使NO2更好被吸收,可采取措施是 ;工业上用Na2 CO3溶液吸收NO2的化学方程式为 。
(3)工业合成氨的化学方程式为 ,选择天然气做为合成氨原料气的优点是 。
(1)①沸腾炉。②98.3%的硫酸。③充分利用能量,提高SO2的转化率。(2)低温、加压;
Na2 CO3+2NO2 NaNO3+NaNO2+CO2。(3)N2+3H2
NaNO3+NaNO2+CO2。(3)N2+3H2 2NH3,原料价格低,能耗低,资源丰富,管道运输投资省,能耗低。
2NH3,原料价格低,能耗低,资源丰富,管道运输投资省,能耗低。
解析试题分析:(1)①根据工业制硫酸的流程示意图判断,设备A的名称为沸腾炉。②为提高SO3的吸收率,吸收塔内试剂X为98.3%的硫酸。③接触室中热交换器的作用是充分利用能量,提高SO2的转化率。(2)工业制硝酸时,酸吸收塔中的水吸收NO2是3NO2+H2O====2HNO3+NO,该反应为放热反应,为使NO2更好被吸收,可采取措施是低温、加压;工业上用Na2 CO3溶液吸收NO2生成硝酸钠、亚硝酸钠和二氧化碳,化学方程式为Na2 CO3+2NO2 NaNO3+NaNO2+CO2。(3)工业合成氨的化学方程式为N2+3H2
NaNO3+NaNO2+CO2。(3)工业合成氨的化学方程式为N2+3H2 2NH3,选择天然气做为合成氨原料气的优点是原料价格低,能耗低,资源丰富,管道运输投资省,能耗低。
2NH3,选择天然气做为合成氨原料气的优点是原料价格低,能耗低,资源丰富,管道运输投资省,能耗低。
考点:考查化学与技术,涉及合成氨工业、硝酸工业、硫酸工业。


科目:高中化学 来源: 题型:填空题
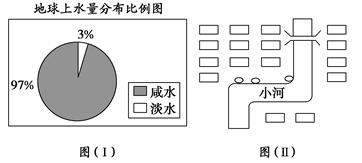
水是生命之源,也是重要的环境要素之一。
(1)观察下图(Ⅰ),若用1 L水来代表地球上的总水量,要比较精确地量取地球上的淡水量,应选择的仪器是__________。
| A.100 mL烧杯 | B.50 mL烧杯 | C.100 mL量筒 | D.50 mL量筒 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
已知:Cu2O + 2H+ =" Cu" + Cu2+ + H2O。
(1)滤液A中铁元素的可能存在形式为_______(填离子符号),与之相关的离子方程式为_____________,若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为_____________________________。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是_________(填代号)。
a.若用硫酸铜溶液作电解液,SO2- 4向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硝酸大量用于制造无机肥料,如硝酸铵、硝酸钙、硝酸磷肥,还广泛用于其他工业生产。硝酸工业生产流程图如下图所示: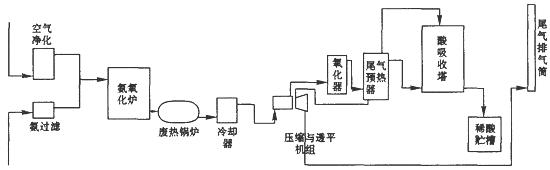
(1)第—步是氨的接触氧化,在一定温度下以铂铑网作为催化剂,写出该反应的化学方程式 。
(2)在吸收塔中用水循环吸收NO2得到硝酸,写出发生该反应的化学方程式 ,该过程是放热的,为了使吸收效果更好,在吸收过程中需要控制在 条件下。
(3)尾气中含有氮的氧化物,直接排放到空气中会危害环境,写出一项氮的氧化物可能引起的环境问题 。工业上常用纯碱溶液吸收NO2,生成亚硝酸盐、硝酸盐和其他物质,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬。其工艺流程如下图所示。
已知:FeSO4+Cr=CrSO4+H2↑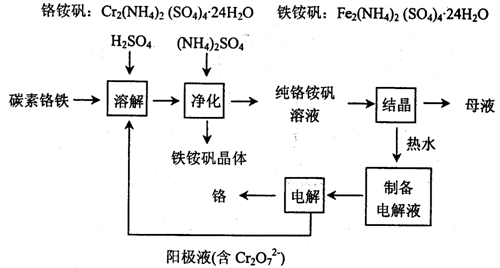
(1)碳素铬铁是铁铬合金,粉碎后溶于硫酸和电解阳极液的混合溶液中。该过程中电解阳极液的主要作用是 。
(2)加入(NH4)2SO4的目的是 。
(3)结晶后的母液从绿色化学的角度可采用的处理方法是 。
(4)产品铬中含氧呈脆性,为了降低其含氧量,可通过 提高其纯度。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
科学家及一些实业家的贡献对科学的发展起着积极地推动作用。下列对有关科学家及其发明创造的叙述,错误的是
| A.拉瓦锡证明了化学反应中的质量守恒,建立了燃烧的新理论 |
| B.舍勒发现了氯气,凯库勒提出了苯的结构式 |
| C.侯德榜发明了“候氏制碱”法,吴蕴初开创了中国的氯碱工业 |
| D.道尔顿、汤姆孙、卢瑟福和门捷列夫等科学家对原子结构模型的建立均作出了卓越的贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某自来水厂利用河水处理成自来水的工艺流程示意图如下图所示:
提供的试剂:饱和Na2CO3溶液、NaOH溶液、生石灰、CC14、BaCl2溶液,KOH溶液
(1)为除水中含有Ca2+、Mg2+、HCO3-、Cl-、SO42-,试剂a代表两种化学物质,主要是除去水中SO42-、Mg2+和HCO3-,这两种试剂是_______和______(只填化学式)。
(2)凝聚剂A常用FeSO4·7H2O,最终生成红褐色胶状沉淀,该胶状沉淀的化学式为______,可以除去其中的悬浮固体颗粒,该过程是______ (填序号)。
A.只有物理变化,无化学变化 B.只有化学变化,无物理变化
C.既有化学变化,又有物理变化
(3)通入CO2的目的是______和______。
(4)传统的氧化剂是Cl2,现代工艺用ClO2取代Cl2,通入CIO2的作用是______,优点是______。
(5)离子交换柱X、Y中有一种是H+型交换柱,另一种是H-型离子交换柱,目的是除去水中残留的杂质离子,则X应是哪种交换柱______(填“H+型”、“OH-型”);如果两个交换柱位置颠倒会产生什么后果____________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学工业有关设备、原料、反应条件配套的是 ( )
| A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30 ℃~35 ℃的氨化饱和食盐水吸收CO2 |
| B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000~5000 ℃ |
| C.合成氨:沸腾炉、焦炭、铁触媒、500 ℃ |
| D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000 ℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com