
【题目】锌铜原电池裝置如图所示,下列说法不正确的是( )
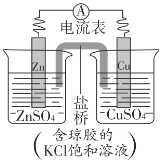
A.锌电极上发生反应:Zn-2e-=Zn2+
B.电子从锌片流向铜片
C.盐桥中K+移向ZnSO4溶液
D.理论上,当6.5gZn溶解时析出6.4gCu
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】按如图进行实验,探究H2O2的分解反应。
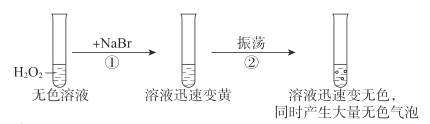
下列说法不正确的是( )
A.NaBr中的Br-加快了H2O2分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2发生分解反应时,转移电子的物质的量是2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G中装有氢氧化钠溶液。
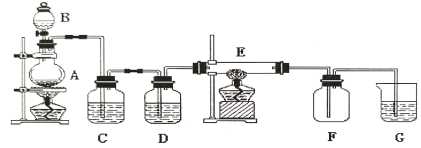
请回答下列问题:
(1)仪器A的名称是_________;B中盛装的药品是_____________;
(2)将实验室制氯气的化学方程式补充完整:MnO2+4HCl(浓)![]() ________ + Cl2↑+ 2H2O;
________ + Cl2↑+ 2H2O;
(3)C装置的作用是____________;D装置的作用是____________;
(4)E中发生化学反应的方程式为__________________;
(5)烧杯G中氢氧化钠溶液的作用是_______________;其发生反应的化学方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、![]() (乙)、
(乙)、![]() (丙)的分子式均为C8H8,下列说法正确的是
(丙)的分子式均为C8H8,下列说法正确的是
A. 甲的同分异构体只有乙和丙两种 B. 甲、乙、丙均可与溴的四氯化碳溶液反应
C. 甲、乙、丙的二氯化物种数最少的是丙 D. 甲中所有原子一定处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3③
2CO(g)+2H2(g) ΔH3③
则反应①自发进行的条件是___,ΔH3=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所得判断正确的是( )
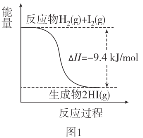
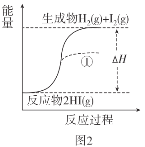
已知:I2(g)=I2(s) ΔH=-62.4kJ/mol
A.图1反应为吸热反应
B.图2反应的热化学方程式为2HI(g)![]() H2(g)+I2(g) ΔH=+9.4kJ/mol
H2(g)+I2(g) ΔH=+9.4kJ/mol
C.图2中若I2的状态为固态,则能量变化曲线可能为①
D.断裂1molH2(g)和1molI2(g)中化学键需要的能量大于断裂2molHI(g)中化学键需要的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)可用作锂离子电池的电极材料。以红土镍矿为原料制备LiCoO2的工艺流程如图:
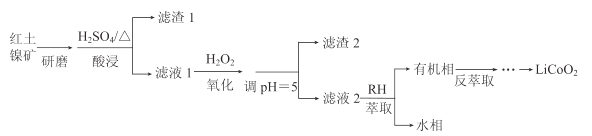
已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有__。
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是__。
②滤渣2的主要成分是__(写化学式)。
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相)![]() CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)
①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为__mol/L。
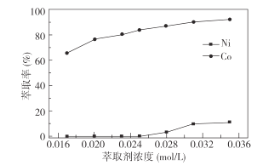
②在__(填“强碱性”或“强酸性”)介质中反萃取,使萃取剂再生而循环利用。
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是__。
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为__。
③在空气中烧结反应的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2 O3、FeO等)生产ZnSO4·7H2O的流程如下:
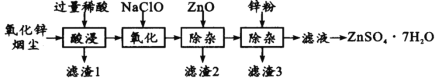
有关金属离子[c(Mn+)= 0.l mol/L]形成氢氧化物沉淀的pH范围如下表:
金属离 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是____;滤渣1主要成分是____。
(2)“氧化”时的离子方程式为_________;加入ZnO除杂时溶液的pH控制范围是____~5.0。
(3)滤渣3含有锌和____;滤液得到ZnSO4·7H2O的操作是____、洗涤、干燥。
(4)取14.35gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 8. 95 | 8. 05 | 6. 72 | 4.05 |
则680℃时剩余固体的化学式为________(填序号)。
A.ZnO B.Zn3O(SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.![]() 与
与![]() 互为同系物
互为同系物
B.分子组成为C4H8O2,其中属于酯的结构有4种
C.乙醇和乙醚互为同分异构体
D.具有相同的分子通式的有机物一定是同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com