
【题目】下列溶液中,Na+ 数目最多的是( )
A.1mol/L Na2SO4溶液200mLB.0.9mol/L Na3PO4溶液200mL
C.2.5mol/L NaOH 溶液100mLD.1mol/L NaHCO3溶液300mL
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】对于放热反应H2+Cl2![]() 2HCl,下列说法正确的是
2HCl,下列说法正确的是
A.该反应涉及到离子键和共价键的断裂与形成
B.该反应中,化学能只转变为热能
C.断开1molH﹣H键和1molCl﹣Cl键所吸收的总能量,小于形成1molH﹣Cl键所放出的能量
D.反应物所具有的总能量高于产物所具有的总能量
[
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铝化合物在生活生产中有广泛应用。
(1)自然界中存在的54Fe和56Fe,它们互称为_____。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因_____。
(3)已知明矾可以净水,明矾化学式_____,试结合离子反应方程式与文字解释明矾净水的原因_____
(4)以NaAlO2溶液、AlCl3溶液、氨水、CO2气体为原料,选择合适试剂,写出实验室制备Al(OH)3的离 子方程式:(任意两条途径)_____、_____
(5)达喜是常用的中和胃酸的药物,其化学成分是铝和镁的碱式盐,化学式为Al2Mg6(OH)16CO3·4H2O【可看做2Al(OH)3·5Mg(OH)2·MgCO3·4H2O】。1mol达喜分别与足量的盐酸和 NaOH 溶液反应,消耗盐酸和 NaOH 的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家发现了一种新分子,它具有空心的类似足球的结构,分子式为C60,下列说法正确的是
A.C60是一种新型的化合物
B.C60和石墨都是碳的同素异形体
C.C60中虽然没有离子键,但固体为离子晶体
D.C60相对分子质量为360
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
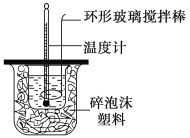
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类不正确的是( )
A.纯碱、烧碱均属于碱类
B.CO2、SiO2、SO2均属于酸性氧化物
C.醋酸、硫酸、硝酸均属于酸类
D.Na2CO3、Na2SO3、NaCl均属于钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体加热到850℃时,可建立下列平衡:CO2+H2![]() CO+H2O(g),在一定温度下,平衡时有90% H2变成水,且平衡常数K=1,则原混合气体中CO2与H2的分子数比为( )
CO+H2O(g),在一定温度下,平衡时有90% H2变成水,且平衡常数K=1,则原混合气体中CO2与H2的分子数比为( )
A. 1︰1 B. 1︰5 C. 1︰10 D. 9︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25 ℃时,向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH)>c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B. 25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C. 0.1![]()
![]() 溶液:
溶液:![]()
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com