
分析 混合后溶液pH=7,则V(盐酸)×c(盐酸)=V(氢氧化钠溶液)×c(NaOH).
解答 解:pH=2的盐酸的物质的量浓度为0.01mol/L,pH=13的NaOH溶液物质的量浓度为$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L.
混合后溶液pH=7,则V(盐酸)×c(盐酸)=V(氢氧化钠溶液)×c(NaOH),
即V(盐酸)×0.01mol/L=V(氢氧化钠溶液)×0.1mol/L,
整理可得:V(盐酸):V(氢氧化钠溶液)=10:1,
故答案为:10:1.
点评 本题考查溶液pH的有关计算,注意强酸与强碱混合呈中性时酸与碱体积之比与pH关系,有利于基础知识的巩固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
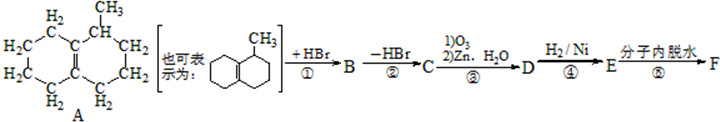 该小组经过上述反应.最终得到F1(
该小组经过上述反应.最终得到F1( )外,还得到它的同分异构体,其中BCDEF分别代表一种或多种物质.
)外,还得到它的同分异构体,其中BCDEF分别代表一种或多种物质.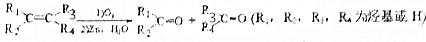
 .
.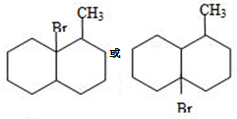 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | X与Y可形成的化合物在5种以上 | |
| B. | 工业上常常通过电解Z的熔融氧化物的方法来获得Z的单质 | |
| C. | 这五种元素形成的简单离子的半径由大到小为:W>Q>X>Y>Z | |
| D. | W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ca2+、SO32-、ClO- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
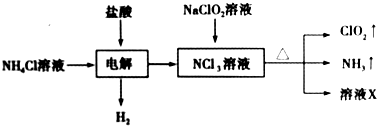
| A. | 电解时发生反应的离子方程式为NH4++3Cl-$\frac{\underline{\;电解\;}}{\;}$2H2↑+NCl3 | |
| B. | 溶液X中大量存在的阴离子有Cl-、OH- | |
| C. | 可用饱和食盐水除去ClO2中的NH3 | |
| D. | 可用明矾除去饮用水中残留的NaClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(CH3COO-) | ||
| C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值 | D. | $\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的比值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com