
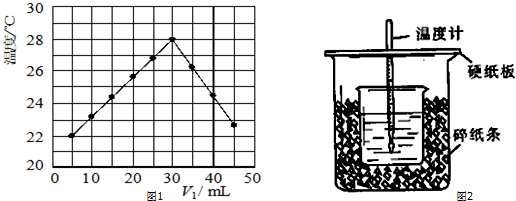
分析 (1)从图示观察的起始温度即为实验时的温度;
(2)由图可知,恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,以此求出两者的体积比值、计算NaOH浓度;
(3)为使酸碱完全反应,应用环形玻璃搅拌棒;根据△H=-$\frac{Q}{n}$算出△H,根据化学计量数和△H关系写出热化学方程式;
(4)根据量热计的构造来判断该装置的缺少仪器,烧杯间需要保温,减少测定误差.
解答 (1)根据实验结果图2所示内容,可以知道该实验开始时温度一定是低于22℃,
故答案为:低于;
(2)恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL,消耗的氢氧化钠溶液的体积为20mL,所以V1/V2=3/2;设恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+NaOH═NaCl+H2O
1 1
1.0mol•L-1×0.03L n
则n=1.0mol•L-1×0.03L=0.03mol,
所以浓度C=$\frac{0.03mol}{0.02L}$=1.5mol/L;
故答案为:3:2;1.5;
(3)20mL 1.5mol/L氢氧化钠与30mL 1.0mol/L盐酸溶液进行中和反应生成水的物质的量为0.02L×1.50mol/L=0.03mol,△H=-$\frac{Q}{0.03}$KJ/mol=-$\frac{100Q}{3}$KJ/mol,反应的热化学方程式为:H+(aq)+OH-(aq)=H2O (l)△H=-$\frac{100Q}{3}$kJ•mol-1或HCl(aq)+NaOH(aq)=NaCl(aq)+H2O (l)△H=-$\frac{100Q}{3}$kJ•mol-1,
故答案为:H+(aq)+OH-(aq)=H2O(l)△H=-$\frac{100Q}{3}$kJ•mol-1或HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-$\frac{100Q}{3}$kJ•mol-1;
(4)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,为保证装置中热量不散失需要把烧杯间填满碎纸条,
故答案为:缺少环形玻璃搅拌棒,烧杯间没有填满碎纸条.
点评 本题结合中和反应的测定考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,题目难度中等.


科目:高中化学 来源: 题型:实验题
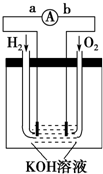 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵与八水合氢氧化钡反应 | |
| B. | 碳与水蒸气高温制取水煤气 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
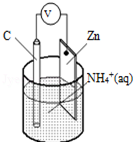 酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的负极 | B. | 氨气在碳棒上生成 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CaO2+2HCl.
CaO2+2HCl.| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2平均生成速率(×10-3mol.s-1) | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
 CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.
CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量. 2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.
2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.| 时间/s | n(CaO2)/mol | n(CaO)/mol | n(O2)/mol |
| 0 | 2 | 0 | 0 |
| 1 | 1.4 | 0.6 | 0.3 |
| 2 | 1 | 1 | 0.5 |
| 3 | 1 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C、D的浓度相等 | B. | A、B、C、D在密闭容器中共存 | ||
| C. | A、B、C、D的浓度不再变化 | D. | A消耗的速率与C消耗的速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com