
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
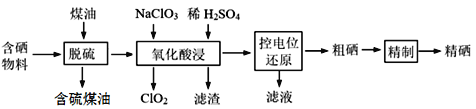
回答下列问题:
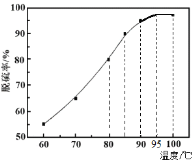
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。
(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为_____________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。
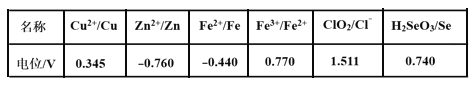
①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(S2-)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为________ %,与粗硒中铁含量为0.89%相比,铁含量明显降低。
【答案】温度升高,单质硫在煤油中的溶解度增加 95℃ 4ClO3-+ 4H+ + Se=4ClO 2↑+ H2O + H2SeO3 ClO2 + 4H+ + 5e-=Cl- + 2H2O 0.345 5.0×10-35 mol·L-1 Na2SeSO3 + H2SO4=Na2SO4 + Se↓+ SO2↑+ H2O 3.2×10-3
【解析】
(1)结合含硒物料的成分和脱硫率随温度的变化图分析;
(2)“氧化酸浸”中,Se在酸性条件下,与氯酸钠发生氧化还原反应转化成H2SeO3;
(3)①根据表格数据,控制电位在0.740~1.511V范围内,ClO2被还原为Cl-;
②结合题意,根据“氧化酸浸”液中主要粒子的电位表数据,分析使硒和杂质金属分离最低电位;
(4) ①利用溶度积表达式Ksp(CuS)= c(S2-) c(Cu2+),结合已知条件计算;
②根据精制流程,硒代硫酸钠与硫酸发生氧化还原反应转化为硒单质;
(5)根据1g精硒中铁含量来计算铁的质量分数。
(1)含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)中含有硫单质,向物料中加入煤油,硫转移到煤油中,说明硫易溶于煤油,结合脱硫率随温度的变化图曲线变化,温度越高,硫单质在煤油中的溶解度越大,且温度控制在95℃脱硫率最高;
(2)“氧化酸浸”中,Se在酸性条件下,与氯酸钠发生氧化还原反应转化成H2SeO3,离子反应方程式为:4ClO3-+ 4H+ + Se=4ClO 2↑+ H2O + H2SeO3;
(3)①根据表格数据,控制电位在0.740~1.511V范围内,在酸性条件下,ClO2得电子被还原为Cl-,该过程的还原反应(半反应)式为:ClO2+4H++5e-=Cl-+2H2O;
②根据题意,电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离,结合“氧化酸浸”液中主要粒子的电位表数据,金属离子的电位都低于0.345,要使硒与杂质金属的分离,最低电位要不低于0.345;
(4) ①已知:c(S2-)=0.026 mol·L-1,Ksp(CuS)=c(S2-)·c(Cu2+)=1.3×10-36,c(Cu2+)=  =5.0×10-35 mol·L-1;
=5.0×10-35 mol·L-1;
②根据精制流程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4,硒代硫酸钠与硫酸发生氧化还原反应转化为硒单质,化学方程式为:Na2SeSO3 + H2SO4=Na2SO4 + Se↓+ SO2↑+ H2O;
(5)设精硒的质量为1g,则1g精硒中含有的铁的质量=32 μg·g-1×1g=32μg=3.2×10-5g,则精硒中铁的质量分数=![]() =3.2×10-3%。
=3.2×10-3%。


科目:高中化学 来源: 题型:
【题目】将A与B的混合物15mol放人容积为2L的密闭容器里,在一定条件下发生反应:2A(g)+3B(g)![]() C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
A.0.15mol·L-1·min-1 B.0.3mol·L-1·min-1
C.0.45mol·L-1·min-1 D.0.6mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的事实或应用、解释的说法不正确的是( )
事实或应用 | 解释 | |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 泡沫灭火器灭火 | Al2(SO4)3与NaHCO3溶液反应产生CO2气体 |
C | 施肥时,草木灰(主要成为K2CO3)与NH4Cl不能混合使用 | K2CO3与NH4Cl反应生成NH3,降低肥效 |
D | 明矾[KAl(SO4)2·12H2O]作净水剂 | 明矾溶于水生成Al(OH)3 胶体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.基于硫代硫酸钠与稀硫酸反应生成S和![]() ,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测
,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测![]() 体积,计算出其反应速率
体积,计算出其反应速率
B.将两块未擦去氧化膜的铝片分别投入![]() 溶液、
溶液、![]() 溶液中,一段时间后,铝片表面都观察不到明显的反应现象
溶液中,一段时间后,铝片表面都观察不到明显的反应现象
C.将20g硝酸钠和17g氯化钾放入100mL烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体
D.试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用![]() 洗涤
洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲装置中所含的是物质的量之比为1∶2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是

A.是该混合溶液中的SO42-导致了A点溶液的pH值小于B点
B.BC段阴极产物和阳极产物的体积之比为2∶1
C.AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是
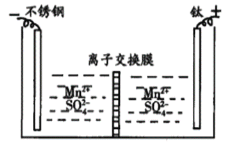
A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):

下列说法正确的是
A.反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),△H增大
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。

(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br + H2 →HBr +H的能量对反应历程的示意图,下列叙述中正确的是( )

A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不改变
C.加入催化剂,该化学反应的活化能不改变
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com